
室温下,下列溶液中粒子浓度大小关系正确的是( )。
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c (OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
科目:高中化学 来源: 题型:
下列化学反应既是放热反应,同时又是氧化还原反应的是( )
A.二氧化碳气体与碳单质高温下的反应 B.八水合氢氧化钡固体与氯化铵固体的反应
C.酸碱中和反应 D.过氧化钠固体与二氧化碳气体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
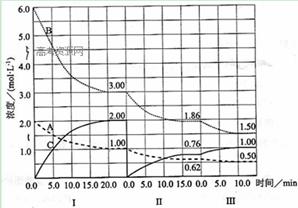 反应aA(g)+bB(g)
反应aA(g)+bB(g)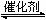 cC(g) (△H<0)在等 容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g) (△H<0)在等 容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
(1)反应的化学方程式中a∶b∶c为 ;
(2)第I阶段20 min内以B表示的平均反应速率 为: , 第I阶段平衡常数K =
(3)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(4)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 ,其值是 ;
(5)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(6)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2 T3(填“<”“>”“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于水解反应的是( )。
A.HCO3- + H2O H3O+ + CO32-
H3O+ + CO32-
B.HCO3- + H3O+ = 2H2O + CO2↑
C.CO2 + H2O H2CO3
H2CO3
D.CO32- + H2O HCO3- + OH-
HCO3- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )。
A.K+、Al3+、NO3-、CO32- B.H+、Na+、Fe2+、NO3-
C.Na+、Ba2+、Cl-、NO3- D.K+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,11.2 L氧气所含的原子数为NA
B. 1.8 g的NH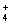 离子中含有的电子数为10NA
离子中含有的电子数为10NA
C. 常温常压下,48 g O3含有的氧原子数为3NA
D. 2.4 g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或者验证气体性质的装置图
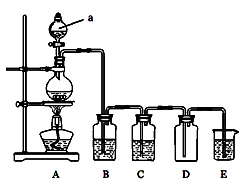
(1) 写出用A制取氯气的化学方程式
(2) 利用上图装置制备纯净、干燥的氯气,并证明氧化性:Cl2>Fe3+
装置B中的溶液的作用为_________________;
装置D中加的最佳试剂为(填序号)________________。
供选试剂:a、浓硫酸 b、FeCl2溶液 c、KSCN与FeCl2的混合溶液
d、无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具有氧化性和漂白性:B中为少量Na2S溶液、C中为品红溶液,D中应加入足量的____________(填溶液名称),E中加入____________溶液(填化学式)
(4)证明碳元素的非金属性比硅元素的强的现象为_________________
实验2不严谨之处应如何改进
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com