
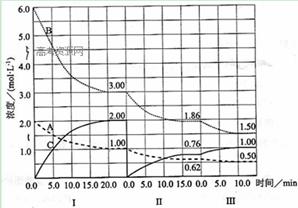
 ��ӦaA(g)+bB(g)
��ӦaA(g)+bB(g)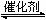 cC(g) (��H��0)�ڵ� �������½��С��ı�������Ӧ�������ڢ����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
cC(g) (��H��0)�ڵ� �������½��С��ı�������Ӧ�������ڢ����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
��1����Ӧ�Ļ�ѧ����ʽ��a��b��cΪ�� ��
��2����I��20 min����B��ʾ��ƽ����Ӧ���� Ϊ: �� ��I��ƽ�ⳣ��K =
��3������ƽ����Ӧ����v��(A)��v��(A)��v��(A)�Ӵ�С���д���Ϊ ��
��4���µ�ƽ��ת���ʦ���(B)������(B)������(B)����С���� ����ֵ�� ��
��5���ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ����� ����ȡ�Ĵ�ʩ�� ��
��6���Ƚϵڢ�η�Ӧ�¶ȣ��ԣ����͵ڢ�η�Ӧ�¶ȣ��ԣ����ĸߵͣ��ԣ� �ԣ����������������������
 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�л���������ǣ� ��
A. 4���һ���6�������� B. 2������4����������
C. 2������4���һ����� D. 1��1һ������3���һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ��ն��ݵ��ܱ�������ʢ��1mol PCl5��������ӦPCl5(g) 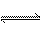 PCl3(g)+Cl2(g),һ��������ƽ��ʱPCl5��ռ������ٷ���ΪM������ͬ������ͬ�����У��������2 mol PCl5����ƽ��ʱ��PCl5������ٷ���ΪN�����н�����ȷ���ǣ� ��
PCl3(g)+Cl2(g),һ��������ƽ��ʱPCl5��ռ������ٷ���ΪM������ͬ������ͬ�����У��������2 mol PCl5����ƽ��ʱ��PCl5������ٷ���ΪN�����н�����ȷ���ǣ� ��
A.M��N B.M=N C.M��N D.���Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��ӦN2+3H2 2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ� ��
2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ� ��
A��N2(g)+3H2(g)  2NH3(1)����H=2(a-b-c)kJ��mol-1
2NH3(1)����H=2(a-b-c)kJ��mol-1
B�� N2(g)+3H2(g)  2NH3(g)����H=2(b-a)kJ��mol-1
2NH3(g)����H=2(b-a)kJ��mol-1
C��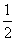 N2(g)+
N2(g)+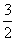 H2(g)
H2(g)  NH3(1)����H=(b+c-a)kJ��mol-1
NH3(1)����H=(b+c-a)kJ��mol-1
D��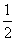 N2(g)+
N2(g)+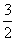 H2(g)
H2(g)  NH3(g)����H=(a+b)kJ��mol-1
NH3(g)����H=(a+b)kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ� ��
A���ڳ����£����ȷ�Ӧһ�����Է����У����ȷ�Ӧ�������Է�����
B����Ϊ�ʱ���ر䶼�뷴Ӧ���Է����йأ�����ʱ���ر�����Ե�����Ϊ��Ӧ�Է��Ե��о�
C��(NH4)2CO3(s)===NH4HCO3(s)��NH3(g)����H����74.9 kJ/mol�����Է����У�ԭ������ϵ���Է�������Ҷ����ӵķ���ת�������
D������������������������£�ʹ�ô������Ըı仯ѧ��Ӧ���еķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ������ƽ���ƶ�ԭ�����͵���(����)��
A����ҵ�ϳɰ�ʱʹ�ô��� B������FeCl3��Һʱ��������������
C�������£�NaOH��Һ����ˮ�������c(H��) <1��10��7mol/L
D��AgCl��ˮ�е��ܽ�ȴ����ڱ���NaCl��Һ�е��ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£�������Һ������Ũ�ȴ�С��ϵ��ȷ����(����)��
A��Na2S��Һ��c(Na+)>c(HS-)>c(OH-)>c(H2S)
B��Na2C2O4��Һ����c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C��Na2CO3��Һ��c(Na+)+c(H+)=2c(CO32-)+c (OH-)
D��CH3COONa��CaCl2�����Һ��c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��̬�����ܱ������������������ȫȼ�գ����ȼ��ǰ�������ڣ��¶ȸ���100�棩ѹǿ���ֲ��䣬����������(����)��
A.C2H6 B.CH4 C.C3H8 D.C3H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���෨�ڻ�ѧѧ�Ƶķ�չ�����˷dz���Ҫ�����ã����з�����������ǣ� ��
�ٸ�������������ʽ�������ֳ��������������������������������
�ڸ��ݷ�Ӧ���Ƿ��е���ת�ƽ���ѧ��Ӧ��Ϊ������ԭ��Ӧ�ͷ�������ԭ��Ӧ
�۸��ݷ�ɢϵ�Ƿ��ж���������Ϊ��Һ�����塢��Һ
�ܸ������Ԫ�ص����ཫ�������Ϊ���ʺͻ�����
�ݸ��ݵ���ʵ�ˮ��Һ����������ǿ��������ʷ�Ϊǿ����ʺ�������ʣ�
A���ڢ� B���ڢۢ� C���٢ۢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com