
下列事实不能用平衡移动原理解释的是( )。
A.工业合成氨时使用催化剂 B.配制FeCl3溶液时,加入少量盐酸
C.常温下,NaOH溶液中由水电离出的c(H+) <1×10—7mol/L
D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
科目:高中化学 来源: 题型:
有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥环己烯;⑦聚丙烯。其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
A.①③⑤ B.④⑥⑦ C.①④⑦ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
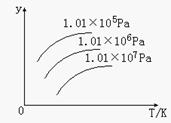
右图表示温度、压强对下列平衡的影响:N2 (g)+3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
图中y轴表示的意义是( )
A. 正反应速率
B. 平衡混合气体中NH3的含量
C. 平衡混合气体中N2的物质的量
D. H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间。图A为温度一定时压强与反应速率的关系曲线;图B为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
A.N2O3(g) NO2(g)+NO(g) ΔH>0
NO2(g)+NO(g) ΔH>0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C.3NO2(g)+H2O(l) 2HNO3(aq)+NO(g) ΔH<0
2HNO3(aq)+NO(g) ΔH<0
D.2CO(g) CO2(g)+C(s) ΔH<0
CO2(g)+C(s) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
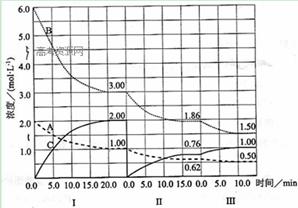 反应aA(g)+bB(g)
反应aA(g)+bB(g)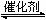 cC(g) (△H<0)在等 容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g) (△H<0)在等 容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
(1)反应的化学方程式中a∶b∶c为 ;
(2)第I阶段20 min内以B表示的平均反应速率 为: , 第I阶段平衡常数K =
(3)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(4)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 ,其值是 ;
(5)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(6)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2 T3(填“<”“>”“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,水的离子积为KW,下列说法正确的是( )。
A.在pH=11的溶液中,水电离出的c(OH-)一定等于10—3mol/L
B.将pH=1的酸溶液和pH=13的碱溶液等体积混合后,混合溶液的pH一定等于7
C.将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+) =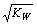
D.若强酸、强碱中和后溶液的pH=7,则中和前酸、碱的pH之和一定等于14
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )。
A.K+、Al3+、NO3-、CO32- B.H+、Na+、Fe2+、NO3-
C.Na+、Ba2+、Cl-、NO3- D.K+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
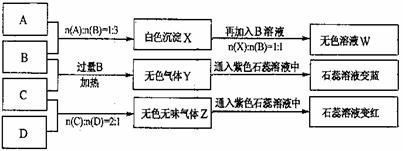
请回答:
(1)A的溶液加热蒸干并灼烧最后所得固体为 (填化学式)。
(2)D溶液pH (填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示) 。
(3)等物质的量浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者 后者(填“<”、“>”或“=”)。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺
序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
列叙述错误的是( )
A.NH3的喷泉实验说明氨气极易溶于水
B.NO 和NH3均可用排空气法收集
C.盛液溴的瓶内加少量水可防止液溴的挥发
D.NH3遇到挥发性的强酸就能冒白烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com