
常温下,水的离子积为KW,下列说法正确的是( )。
A.在pH=11的溶液中,水电离出的c(OH-)一定等于10—3mol/L
B.将pH=1的酸溶液和pH=13的碱溶液等体积混合后,混合溶液的pH一定等于7
C.将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+) =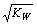
D.若强酸、强碱中和后溶液的pH=7,则中和前酸、碱的pH之和一定等于14
科目:高中化学 来源: 题型:
已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
A. 60% B. 84% C.91% D.42%
查看答案和解析>>
科目:高中化学 来源: 题型:
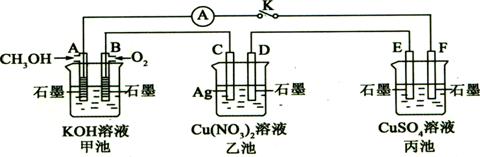
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
 |
请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为 。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO 的物质的量和容器Ⅱ中的一样多
D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用平衡移动原理解释的是( )。
A.工业合成氨时使用催化剂 B.配制FeCl3溶液时,加入少量盐酸
C.常温下,NaOH溶液中由水电离出的c(H+) <1×10—7mol/L
D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )。
A、pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D、pH相同的 ①CH3COONa ②NaHCO3 ③NaClO 三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ksp(AgCl) = 1.56×10-10,Ksp(AgBr) = 7.7×10-13,Ksp(Ag2CrO4) = 9.0×10-12。某溶
液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1
的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )。
A.Cl-、Br-、CrO42- B.CrO42-、Br-、Cl-
C.Br-、Cl-、CrO42- D.Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.化学家可以制造出自然界中不存在的物质
B.化学研究的主要目的就是认识分子
C.化学科学与其他科学分支的联系不密切
D.化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
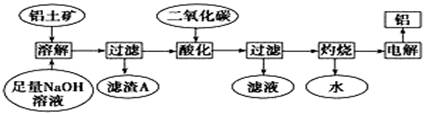
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的Na2SiO3与Na2[Al(OH)4]与反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na2[Al(OH)4]=2Na2Al2Si2O8↓+2H2O+4 NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中主要发生反应的离子方程式:__________________________;_____________________________。
(2)滤渣A的主要成分为 ;滤渣A的用途是(只写一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com