
下列图示实验正确的是 ( ) 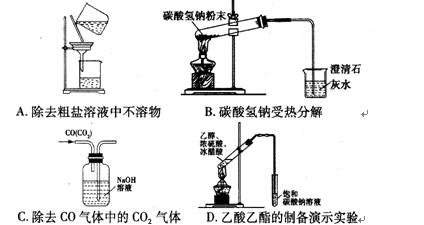
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:实验题
某同学进行硫酸铜晶体结晶水含量的测定实验。完成下列填空:
【实验步骤】
(1)用_______(填仪器名称,下同)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入约2 g研细的硫酸铜晶体,并称量。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至____________中冷却到室温,并称量。
(4)重复(3)的实验进行恒重操作,直至两次称量结果相差不超过0.001 g。
【数据记录与处理】
| | 第一次实验 | 第二次实验 |
| 坩埚的质量(g) | 29.563 | 30.064 |
| 坩埚+试样的质量(g) | 31.676 | 32.051 |
| 恒重后,坩埚+硫酸铜的质量(g) | 30.911 | 31.324 |
| x的值 | 5.05 | 5.13 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
白云石的主要成分为CaCO3、MgCO3,还含有少量Fe、Si的化合物,实验室以白云石为原料制Mg(OH)2及CaCO3。步骤如下:
实验过程中需要的数据见下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)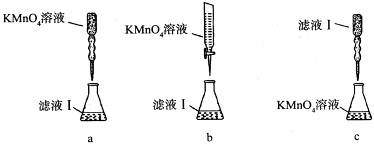
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。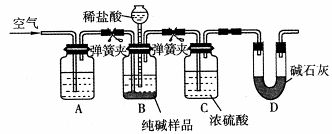
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
白菜中含有钙铁等元素,某化学小组设计如下方案测定干白菜中钙元素的质量分数。首先取10.00g干白菜叶,灼烧得白菜灰粉进行下列实验: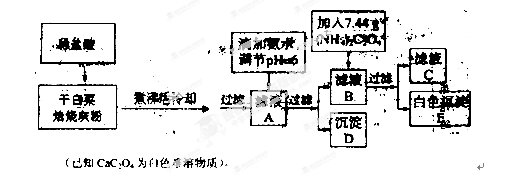
(1)实验前要先将干白菜叶样品高温灼烧成灰粉,其主要目的是使样品中的有机物完全分解,使干白菜叶中的钙、铁元素溶解完全,灼烧用到的部分仪器有
A.坩埚 B.蒸发皿 C.玻璃棒 D.泥三角
(2)写出从滤液A→沉淀D的离子反应方程式 。
(3)用KMnO4标准溶液滴定滤液C:先将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.100 0 mol·L-1’的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL。
发生的反应为:
①滴定的过程中,同学们发现一个现象:向C溶液中加入第一滴KMnO4溶液时,需要振摇锥形瓶较长时间才能褪色,当溶液褪色后,再滴入KMnO4溶液,则迅速褪色,直至达到终点;为了加快滴入第一滴KMnO4溶液时的褪色速度,可采取的方法是 .(选择合适的选项)
A.适当加热锥形瓶内溶液 B.在锥形瓶内加少量水
C.在锥形瓶内加适量乙醇 D.在锥形瓶内加入几滴MnSO4溶液
②判断滴定达到终点的方法是 。
(4)原干白菜叶中钙元素的质量分数为 。
(5)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是 。如果沉淀E未洗涤,或未将洗涤液转移回母液,则测得的钙元素质量分数 (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
| A.分液、萃取、蒸馏 | B.分液、蒸馏、萃取 |
| C.萃取、蒸馏、分液 | D.蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列对实验现象的解释与结论正确的是
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4, 该溶液中一定含有SO42- |
| B | 向鸡蛋清溶液中, 加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了盐析 |
| C | 向甲苯中滴入少量浓溴水, 振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应, 使溴水褪色 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性, 反应中生成C、SO2和CO2等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com