
白云石的主要成分为CaCO3、MgCO3,还含有少量Fe、Si的化合物,实验室以白云石为原料制Mg(OH)2及CaCO3。步骤如下:
实验过程中需要的数据见下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |

(12分)(1)玻璃棒、烧杯、漏斗(2分);BC(2分)
(2)NH3(1分);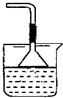 (2分,使用干燥管也得分)
(2分,使用干燥管也得分)
(3) Ksp[Fe(OH)3]<Ksp[Fe(OH)2]<Ksp[Mg(OH)2](2分)
(4)Mg(OH)2受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳。(2分,答出其中一个方面即可)
解析试题分析:根据流程可知,白云石加盐酸反应后的溶液中主要为氯化钙、氯化镁、氯化亚铁、氯化铁,加试剂①将亚铁离子氧化为铁离子,再加氧化镁除去铁离子,溶液C中主要含Ca2+、Mg2+,加CaO促进镁离子水解从而除去镁离子。
(1)过滤操作中的主要仪器是铁架台(带铁圈)、烧杯、玻璃棒、漏斗,因此主要的玻璃仪器是烧杯、玻璃棒、漏斗。由于选择氧化剂时不能引入新的杂质,高锰酸钾的还原产物是Mn2+,属于杂质,因此不能选择高锰酸钾溶液,所以试剂①为氯气或双氧水,即答案选B或C。
(2)CO2溶于水,溶液显酸性,不能和氯化钙反应生成白色沉淀。所以要制备碳酸钙沉淀,应该首先通入氨气,然后再通入CO2。由于氨水溶液显碱性,所以通入二氧化碳时应注意防止倒吸,因此正确的装置图可以为 。
。
(3)由表格中的数据可知,沉淀的pH越小,则溶度积越小。所以Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序Ksp[Fe(OH)3]<Ksp[Fe(OH)2]<Ksp[Mg(OH)2]。
(4)Mg(OH)2起阻燃作用的主要原因是Mg(OH)2受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳。故答案为:Mg(OH)2受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.
考点:考查过滤操作、氧化剂的选择;碳酸钙制备、防倒吸装置的选择;溶度积常数的判断以及氢氧化镁的性质与用途等


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子__________________________________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________________________________________________________。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
研究性学习小组对某硫酸亚铁晶体(FeSO4?xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。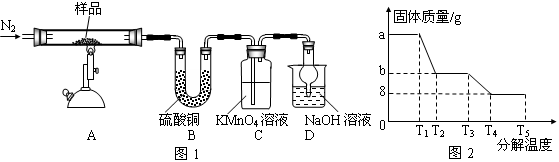
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x
=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O及CaCO3,部分步骤如下: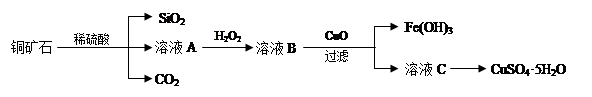
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号);在溶液A中加入H2O2反应的离子方程式是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。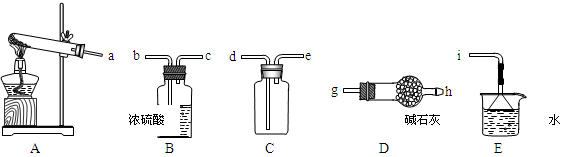
如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是
_________(填编号)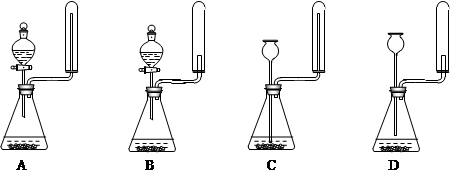
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还 可以作为鱼池增氧剂。査阅文献:过氧化钙的制备方法一般有两种方案。利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2·8H2O沉淀。已知CaO2·8H2O呈白色,微溶于水,在60℃下烘0.5小时可形成CaO2·2H2O,再在 140℃下烘0.5小时,得无水CaO2。加热至350℃左右开始分解放出氧气。
已知某化工厂生产过氧化钙的主要工艺流程如下: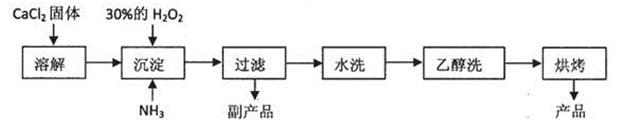
某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是: 。
(2)检验“水洗”是否合格的方法是: 。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
② 。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为 。
②CaO2的质量分数为 (用字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
试回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)装置B、C应盛放的药品分别是 、 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用的措施是 、如何防止E中液体挥发? 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
I.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生_______反应。
II.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案l:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行? _______,理由是__________________________________________
(2)假设测得反应前用于溴水制备的Br2的物质的量为a mol 。
若测得反应后n(Br-) = _______mol,则说明溴水与乙醛发生加成反应;;
若测得反应后n(Br-) = _______mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-) = _______mol,则说明猜测(3)正确。
III.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀l.88 g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为__________________________________________。
IV.拓展
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
| 实验操作步骤 | 实验现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列除去杂质(括号内物质为少量杂质)的方法中,正确的是( )
| A.乙烷(乙烯):光照条件下通入Cl2,气液分离 |
| B.乙酸乙酯(乙酸):用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 |
| C.CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶 |
| D.乙醇(乙酸):加足量浓硫酸,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com