
ЁОЬтФПЁПРћгУLiOHКЭюмбѕЛЏЮяПЩжЦБИяЎРызгЕчГие§МЋВФСЯЁЃLiOHПЩгЩЕчНтЗЈжЦБИЃЌюмбѕЛЏЮяПЩЭЈЙ§ДІРэюмдќЛёЕУЁЃ
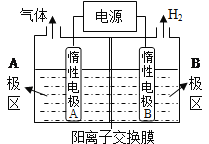
ЃЈ1ЃЉРћгУШчЭМзАжУЕчНтжЦБИLiOHЃЌСНЕчМЋЧјЕчНтвКЗжБ№ЮЊLiOHКЭLiClШмвКЃЎBМЋЧјЕчНтвКЮЊ ЁЁШмвКЃЈЬюЛЏбЇЪНЃЉЃЌбєМЋЕчМЋЗДгІЪНЮЊЁЁ ЁЁЃЛЕчНтЙ§ГЬжаLi+ЯђЁЁ ЁЁЕчМЋЧЈвЦЃЈЬюЁАAЁБЛђЁАBЁБЃЉЁЃ
ЃЈ2ЃЉРћгУюмдќ[КЌCo(OH)3ЁЂFe(OH)3ЕШ]жЦБИюмбѕЛЏЮяЕФЙЄвеСїГЬШчЯТЃК

Co(OH)3ШмНтЛЙдЗДгІЕФРызгЗНГЬЪНЮЊЁЁ ЁЁЃЌЬњдќжаЬњдЊЫиЕФЛЏКЯМлЮЊЁЁ ЃЌдкПеЦјжаьбЩеCoC2O4ЩњГЩюмбѕЛЏЮяКЭCO2ЃЌВтЕУГфЗжьбЩеКѓЙЬЬхжЪСПЮЊ2.41gЃЌCO2ЕФЬхЛ§ЮЊ1.344LЃЈБъзМзДПіЃЉЃЌдђюмбѕЛЏЮяЕФЛЏбЇЪНЮЊЁЁ ЁЁЁЃ
ЁОД№АИЁПЃЈ1ЃЉLiOH ЃЛ 2ClЁЊЉ2eЉ=Cl2Ёќ ЃЛ B
ЃЈ2ЃЉ2Co(OH)3+4H++SO32Љ=2Co2++SO42Љ+5H2O ЃЛ +3 ЃЛ Co3O4
ЁОНтЮіЁПЪдЬтЗжЮіЃКЃЈ1ЃЉBМЋЧјЩњВњH2ЃЌЭЌЪБЩњГЩLiOHЃЌдђBМЋЧјЕчНтвКЮЊLiOHШмвКЃЛЕчМЋAЮЊбєМЋЃЌбєМЋЧјЕчНтвКЮЊLiClШмвКЃЌИљОнЗХЕчЫГађЃЌбєМЋЩЯClЪЇШЅЕчзгЃЌдђбєМЋЕчМЋЗДгІЪНЮЊЃК2ClЁЊ2e=Cl2ЁќЃЛИљОнЕчСїЗНЯђЃЌЕчНтЙ§ГЬжаLi+ЯђBЕчМЋЧЈвЦЁЃ
ЃЈ2ЃЉдкЫсадЬѕМўЯТЃЌCoЃЈOHЃЉ3ЪзЯШгыH+ЗДгІЩњГЩCo3+ЃЌCo3+ОпгабѕЛЏадЃЌАбSO32бѕЛЏЮЊSO42ЃЌХфЦНПЩЕУРызгЗНГЬЪНЃК2CoЃЈOHЃЉ3+4H++SO32=2Co2++SO42+5H2OЃЛТШЫсФЦОпгаЧПбѕЛЏадЃЌвђДЫЬњдќжаЬњдЊЫиЕФЛЏКЯМлгІИУЮЊ+3МлЃЛCO2ЕФЮяжЪЕФСПЮЊЃК1.344LЁТ22.4L/mol=0.06molЃЌИљОнCoC2O4ЕФзщГЩПЩжЊCoдЊЫиЮяжЪЕФСПЮЊ0.03molЃЌЩшюмбѕЛЏЮяЕФЛЏбЇЪНЮЊCoxOyЃЌИљОндЊЫиЕФжЪСПБШПЩЕУЃК59xЃК16y=0.03molЁС59g/molЃКЃЈ2.41gЁЊ0.03molЁС59g/molЃЉЃЌНтЕУxЃКy=3:4ЃЌдђюмбѕЛЏЮяЕФЛЏбЇЪНЮЊЃКCo3O4ЁЃ


 ЦкФЉГхДЬ100ЗжДДаТН№ОэЭъШЋЪдОэЯЕСаД№АИ
ЦкФЉГхДЬ100ЗжДДаТН№ОэЭъШЋЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
AЁЂЬњгыЯЁH2SO4ЗДгІЪБЃЌМгШыЩйСПCuSO4ШмвКЃЌПЩЪЙЗДгІЫйТЪМгПь
BЁЂЙЙГЩдЕчГиЕФе§МЋКЭИКМЋБиаыЪЧСНжжВЛЭЌЕФН№Ъє
CЁЂдкЬњЩЯЖЦЭЪБЃЌН№ЪєЭзївѕМЋ
DЁЂгУЖшадЕчМЋЕчНтCuSO4ШмвКЃЌШмвКЕФpHВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЬжмЦкдЊЫиAЁЂBЁЂCЁЂDзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЗжБ№ЮЊXЁЂYЁЂZЁЂWЃЌAЪЧЖЬжмЦкжадзгАыОЖзюДѓЕФдЊЫиЃЌГЃЮТЯТXЁЂZЁЂWОљПЩгыYЗДгІЃЌAЁЂCЁЂDЕФдзгађЪ§МА0.1mol/L XЁЂZЁЂWШмвКЕФpHШчЭМЫљЪОЃЈвбжЊlg2=0.3ЃЉЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
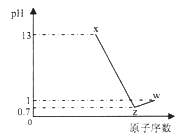
A. AЕФРызгАыОЖаЁгкBЕФРызгАыОЖ
B. WЁЂXСНЮяжЪКЌгаЕФЛЏбЇМќРраЭЯрЭЌ
C. DЧтЛЏЮяЮШЖЈадаЁгкCЧтЛЏЮяЮШЖЈад
D. BЕФМђЕЅРызгЛсгАЯьЫЎЕФЕчРыЦНКт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвжЦБИ1,2ЖўфхввЭщЕФЗДгІдРэШчЯТЃК
CH3CH2OH![]() CH2===CH2ЁќЃЋH2O
CH2===CH2ЁќЃЋH2O
CH2===CH2ЃЋBr2ЁњBrCH2CH2Br
ПЩФмДцдкЕФИБЗДгІгаввДМдкХЈСђЫсДцдкЯТ140ЁцЪБЭбЫЎЩњГЩввУбЁЃ
гУЩйСПЕФфхКЭзуСПЕФввДМЗДгІжЦБИ1,2ЖўфхввЭщЕФзАжУШчЭМЫљЪОЃК
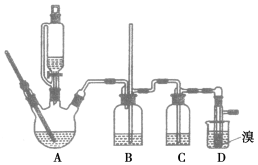
ввДМ | 1,2ЖўфхввЭщ | ввУб | |
зДЬЌ | ЮоЩЋвКЬх | ЮоЩЋвКЬх | ЮоЩЋвКЬх |
УмЖШ/gЁЄcmЃ3 | 0.79 | 2.2 | 0.71 |
ЗаЕу/Ёц | 78.5 | 132 | 34.6 |
ШлЕу/Ёц | Ѓ130 | 9 | Ѓ116 |
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)дкДЫжЦБИЪЕбщжаЃЌвЊОЁПЩФмбИЫйЕиАбЗДгІЮТЖШЩ§ИпЕН170ЁцзѓгвЃЌзюжївЊЕФФПЕФЪЧ________(ЬюађКХЃЌЯТЭЌ)ЁЃ
aЃЎв§ЗЂЗДгІ
bЃЎМгПьЗДгІЫйЖШ
cЃЎЗРжЙввДМЛгЗЂ
dЃЎМѕЩйИБВњЮяввУбЩњГЩ
(2)дкзАжУCжагІМгШы___________ЃЌЦфФПЕФЪЧЮќЪеЗДгІжаПЩФмЩњГЩЕФЫсадЦјЬхЁЃ
aЃЎЫЎ bЃЎХЈСђЫс
cЃЎЧтбѕЛЏФЦШмвК dЃЎБЅКЭЬМЫсЧтФЦШмвК
(3)ХаЖЯИУжЦБИЗДгІвбОНсЪјЕФзюМђЕЅЗНЗЈЪЧ____________________ЁЃ
(4)НЋ1,2ЖўфхввЭщДжВњЦЗжУгкЗжвКТЉЖЗжаЃЌМгЫЎеёЕДКѓОВжУЃЌВњЮягІдк________(ЬюЁАЩЯЁБЛђЁАЯТЁБ)ВуЁЃ
(5)ШєВњЮяжагаЩйСПЮДЗДгІЕФBr2ЃЌзюКУгУ________ЯДЕгГ§ШЅЁЃ
aЃЎЫЎ bЃЎЧтбѕЛЏФЦШмвК
cЃЎЕтЛЏФЦШмвК dЃЎввДМ
(6)ШєВњЮяжагаЩйСПИБВњЮяввУбЃЌПЩгУ________ЕФЗНЗЈГ§ШЅЁЃ
(7)ЗДгІЙ§ГЬжагІгУРфЫЎРфШДзАжУDЃЌЦфжївЊФПЕФЪЧ________________ЃЛЕЋгжВЛФмЙ§ЖШРфШД(ШчгУБљЫЎ)ЃЌЦфдвђЪЧ____________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗжЖЬжмЦкдЊЫиAЁЂBЁЂCЁЂDЕФдзгађЪ§вРДЮдіДѓЃЌCКЭDЮЛгкЭЌжїзхЧвдзгађЪ§ЯрВю8ЃЛЛљЬЌAдзгКЫЭтга3ИіФмМЖЩЯШнФЩЕчзгЧвУПИіФмМЖЩЯЕчзгЪ§ЯрЕШЃЌCдзгsФмМЖЕчзгзмЪ§гыpФмМЖЕчзгЪ§ЯрЕШЃЛЛљЬЌEдзгЕФMВуЩЯга2ИіЮДГЩЖдЕчзгЧвЮоПеЙьЕРЁЃ
ЃЈ1ЃЉЛљЬЌEдзгЕФМлВуЕчзгЙьЕРБэЪОЪНЮЊ ЁЃ
ЃЈ2ЃЉдЊЫиAЁЂBЁЂCЕФЕквЛЕчРыФмгЩДѓЕНаЁХХађЮЊ (гУдЊЫиЗћКХБэЪО)
ЃЈ3ЃЉAC32-ЕФжааФдзгдгЛЏРраЭЮЊ ЃЛDC32-ЕФПеМфЙЙаЭЮЊ ЁЃ
ЃЈ4ЃЉвбжЊ(DAB)2ЗжзгжаКЌЗЧМЋадМќЃЌЗжзгжаУПИідзгзюЭтВуЖМДяЕН8ИіЕчзгЮШЖЈНсЙЙЃЌ1mol(DAB)2ЗжзгКЌІвМќЕФЪ§ФПЮЊ ЁЃ аДГівЛжжгыDAB-РызгЛЅЮЊЕШЕчзгЬхЕФЗжзг (ЬюЛЏбЇЪН)
ЃЈ5ЃЉХфКЯЮяE(AC)4дкГЃЮТЯТГЪвКЬЌЃЌвзШмгкЫФТШЛЏЬМЁЂБНЕШгаЛњШмМСЁЃЙЬЬЌE(AC)4ЕФОЇЬхРраЭЪЧ ЁЃ
ЃЈ6ЃЉШЫЙЄКЯГЩЕФECОЇЬхДцдкШБЯнЃЌМДбєРызгга+3ЁЂ+2МлСНжжЁЃФГЙЄШЫКЯГЩЕФОЇЬхбљЦЗзщГЩЮЊE0.96CЃЌдђИУОЇЬхжа+3МлЁЂ+2МлСНжжРызгЕФИіЪ§жЎБШЮЊ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЬжмЦкдЊЫиXЁЂYЁЂZЁЂMЕФдзгађЪ§вРДЮдіДѓЃЌдЊЫиXЕФвЛжжИпгВЖШЕЅжЪЪЧБІЪЏЃЌY2+ЕчзгВуНсЙЙгыФЪЯрЭЌЃЌZЕФжЪзгЪ§ЮЊХМЪ§ЃЌЪвЮТЯТMЕЅжЪЮЊЕЛЦЩЋЙЬЬхЃЌЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉMдЊЫиЮЛгкжмЦкБэжаЕФЕк______жмЦкЁЂ_______зхЁЃ
ЃЈ2ЃЉZдЊЫиЪЧ____ЃЌЦфдкздШЛНчжаГЃМћЕФЖўдЊЛЏКЯЮяЪЧ____ЁЃ
ЃЈ3ЃЉXгыMЕФЕЅжЪдкИпЮТЯТЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЃЌВњЮяЗжзгЮЊжБЯпаЮЃЌЦфЛЏбЇМќЪє__________ЙВМлМќЃЈЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБЃЉЁЃ
ЃЈ4ЃЉЫФжждЊЫижаЕФ ПЩгУгкКНПеКНЬьКЯН№ВФСЯЕФжЦБИЃЌЦфЕЅжЪгыЯЁбЮЫсЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПе§Х№Ыс(H3BO3)ЪЧвЛжжВузДНсЙЙАзЩЋОЇЬхЃЌВуФкЕФH3BO3ЗжзгЭЈЙ§ЧтМќЯрСЌ(ШчЭМ)ЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
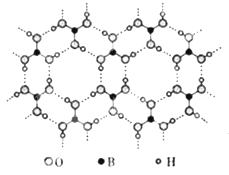
AЃЎе§Х№ЫсОЇЬхЪєгкЗжзгОЇЬх
BЃЎЗжзгжаХ№дзгзюЭтВуЮЊ8eЃЮШЖЈНсЙЙ
CЃЎH3BO3ЗжзгЕФЮШЖЈадгыЧтМќгаЙи
DЃЎКЌ1mol H3BO3ЕФОЇЬхжага6molЧтМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђ14.8g Fe2O3ЁЂFeOКЭCuЕФЛьКЯЮяжаЃЌМгШы1mol. L![]() СђЫсШмвК200mLЪБЃЌЙЬЬхЧЁКУЭъШЋШмНтЃЌЫљЕУШмвКжаВЛКЌFe3+ЁЃШєгУзуСПЕФCOдкИпЮТЯТЛЙдЯрЭЌжЪСПЕФдЛьКЯЮяЃЌЕУЕНЕФЙЬЬхжЪСПЮЊЃЈ ЃЉ
СђЫсШмвК200mLЪБЃЌЙЬЬхЧЁКУЭъШЋШмНтЃЌЫљЕУШмвКжаВЛКЌFe3+ЁЃШєгУзуСПЕФCOдкИпЮТЯТЛЙдЯрЭЌжЪСПЕФдЛьКЯЮяЃЌЕУЕНЕФЙЬЬхжЪСПЮЊЃЈ ЃЉ
A. 11.6g B. 10.8g C. 8.4g D.13.2g
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЖўдЊЫс(ЛЏбЇЪНгУH2BБэЪО)дкЫЎжаЕФЕчРыЗНГЬЪНЃКH2B=H++HB-ЃЌHB-![]() H++B2-ЁЃЛиД№ЯТСаЮЪЬтЃК
H++B2-ЁЃЛиД№ЯТСаЮЪЬтЃК
(1) NaHBШмвКЯд (ЬюЁАЫсадЁБЁАжаадЁБЛђЁАМюадЁБ)ЁЃРэгЩЪЧ ЁЃ
(2)дк0ЃЎ1 molЁЄL-1ЕФNa2BШмвКжаЃЌЯТСаСЃзгХЈЖШЙиЯЕЪНе§ШЗЕФЪЧ ЁЃ
AЃЎc(B2-)+c(HB-)+c(H2B)=0.1 molЁЄL-1
BЃЎc(OH-)=c(H+)+c(HB-)
CЃЎc(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
DЃЎc(Na+)=2c(B2-)+2c(HB-)
(3)0.1 molЁЄL-1 Na2BШмвКжаИїжжРызгХЈЖШгЩДѓЕНаЁЕФЫГађЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com