
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
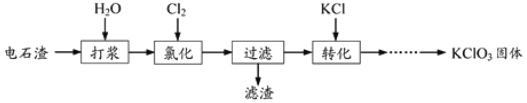
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
① 生成Ca(ClO)2的化学方程式为 。
② 提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。
① 滤渣的主要成分为 (填化学式)。
② 滤液中Ca(ClO3)2与CaCl2物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)
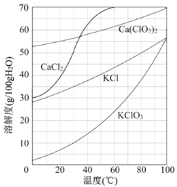
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
【答案】(1)①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;②AB;(2)①CaCO3、Ca(OH)2 ; ②<;(3)蒸发浓缩、冷却结晶。
【解析】
试题分析:(1)次氯酸钙是有氯气和氢氧化钙反应制备,氯气自身发生氧化还原反应,其反应方程式为2Cl2+2Ca(OH)2=Ca(ClO2)2+CaCl2+2H2O;②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2的速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解浓度过稀,对后续实验不利,因此AB正确;(2)①电石渣的成分是Ca(OH)2、CaCO3,根据流程图,CaCO3不参与反应,且CaCO3属于难溶物,则滤渣中含有CaCO3,Ca(OH)2微溶于水,滤渣中也含有Ca(OH)2;②根据信息,少量的Ca(ClO3)分解,因此两者的物质的量比值<1:5;(3)根据溶解度和温度的图像,KClO3溶解度受温度的影响较大,蒸发浓缩,达到饱和溶液,然后冷却结晶。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯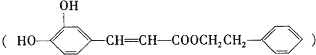 是一种天然抗癌药物,在一定条件下能发生如下转化
是一种天然抗癌药物,在一定条件下能发生如下转化
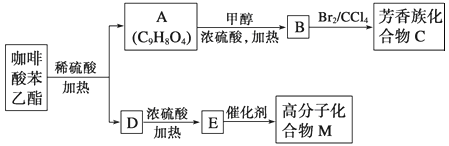
请回答下列问题:
(1)D分子中的官能团是__________;
(2)高分子化合物M的结构简式是__________;
(3)写出A→B反应的化学方程式:__________;
(4)B→C的反应类型为__________;
(5)1molA最多可消耗__________molNaOH;
(6)一定条件下1molA最多与__________mol氢气加成
(7)A的同分异构体有很多种,其中,同时符合下列条件的同分异构体的结构简式:__________
①苯环上只有两个取代基 ②能发生银镜反应 ③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铜和稀硝酸反应产生一氧化氮气体,某学校学生实验小组设计了一个实验,其装置如下图所示(加热装置与固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球。
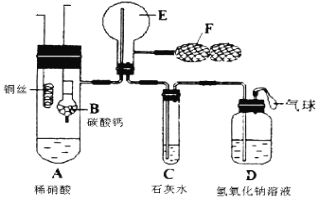
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深。假设装置E的体积为66mL,空气残留量为10mL,要鼓入 mL的空气才能将NO全部氧化(设氧气占空气体积的1/5,且所有气体都在同温同压下)。
(4)一段时间后,C中白色沉淀溶解,其原因是 、 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:
步骤1.在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
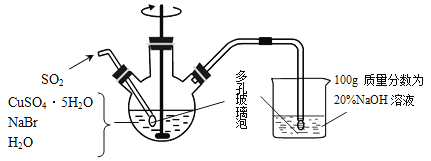
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去其中水中的 (写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为 ;
②控制反应在60℃进行,实验中可采取的措施是 ;
(3)步骤2过滤需要避光的原因是 。
(4)步骤3中洗涤剂需“溶有SO2”的原因是 ;最后溶剂改用乙醚的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解NaCl溶液生成氯气的化学方程式为 。
(2)Cl2溶于H2O、NaOH溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl2与H2O、NaOH的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如图所示:
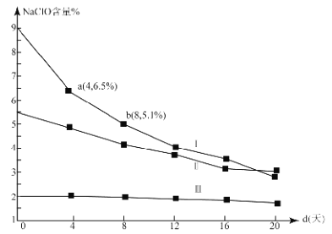
①分解速率v(Ⅰ) v(Ⅱ)(填“>”“<”或“=”),原因是 。
②NaClO分解的化学方程式是 。
③4d-8d,Ⅰ中v(NaClO)= mol/(L·d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是
A. 用钢瓶储存液氯或浓硫酸
B. 硅胶可用作食品干燥剂
C. PM 2.5是指大气中直径接近2.5×10-6 m的颗粒物,它分散在空气中形成胶体
D. 神舟10号飞船所用太阳能电池板的材料是单晶硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com