
分析 (1)乙醇发生消去反应生成乙烯;
(2)需加入碎瓷片防止液体沸腾;
(3)A、配制乙醇与浓硫酸的混合液时,将密度大的液体注入密度小的液体中,便于混合;
B、加热混合液时,应迅速升高温度为170℃,防止发生副反应;
C、温度计测定反应液的温度;
D、乙烯不溶于水,密度比空气的密度接近;
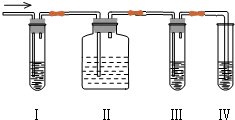
(4)确认上述混合气体中有C2H4和SO2,结合实验装置可知,I中为品红,II中为溴水或NaOH溶液吸收二氧化硫,III中为品红,IV中为高锰酸钾溶液或溴水,以此来解答.
解答 解:(1)实验室制乙烯的化学方程式为C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O,故答案为:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O;
(2)该实验需加入碎瓷片目的是防暴沸,故答案为:防暴沸;
(3)A、配制乙醇与浓硫酸的混合液时,将密度大的液体注入密度小的液体中,便于混合,则将浓硫酸注入乙醇中并不断搅拌,故A错误;
B、加热混合液时,应迅速升高温度为170℃,防止发生副反应生成乙醚,故B错误;
C、温度计测定反应液的温度,则温度计水银球的位置应伸入液面之下,而不是液面之上,故C正确;
D、乙烯不溶于水,密度比空气的密度接近,则收集乙烯气体时应用排水法收集,不能用排空气法收集,故D正确;
故答案为:C D;
(4)①确认上述混合气体中有C2H4和SO2,结合实验装置可知,I中为品红,II中为溴水或NaOH溶液吸收二氧化硫,III中为品红,IV中为高锰酸钾溶液或溴水,
故答案为:D;A或C; D; B或C;
②能说明SO2气体存在的现象是I中品红褪色,故答案为:I中品红褪色;
③确定含有乙烯的现象是III中品红不褪色,IV中KMnO4溶液褪色或溴水褪色,故答案为:III中品红不褪色,IV中KMnO4溶液褪色或溴水褪色.
点评 本题考查物质的制备及性质实验,为高频考点,把握物质的性质、发生的反应、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验设计的能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 可用焰色反应来证明某试样中是否含有钠元素 | |
| B. | 至少用二种试剂通过化学反应能区别开硫酸铵、硫酸钾、氯化铵 | |
| C. | 配制物质的量溶液定容时,加水超过刻度线,用胶头滴管吸出 | |
| D. | 粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~5min,SO2的生成速率v(SO2)=0.12mol•L-1•min-1 | |
| B. | 若起始时充入3 mol SO3,起始时SO3分解速率不变 | |
| C. | 若某时刻消耗了1 molSO3同时生成了0.5molO2,则表明该反应达到了平衡状态 | |
| D. | 达到平衡时,SO2和SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
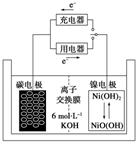 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时电池正极的电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时K+移向负极 | |
| C. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| D. | 该电池充电时将碳电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )| A. | 该有机物属于苯的同系物 | B. | 该有机物属于芳香烃 | ||
| C. | 该有机物分子中含有22个碳原子 | D. | 该有机物一氯代物只有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与盐酸反应:O2-+2H+=H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3+2HClO | |
| C. | 大理石跟盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 醋酸和氨水反应:H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com