
分析 (1)要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据电荷守恒计算溶液中铵根离子浓度;
(2)依据质量守恒定律及m=cVM计算需要溶质的质量;
(3)依据溶液中所含离子成分及浓浓度关系判断解答;稀释过程中溶质的物质的量不变,据此计算出稀释后溶液中氯化铵的浓度.
解答 解:(1)所得溶液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据溶液中电荷守恒规律可知:c(Cl-)+2c(SO42-)=c(K+)+c(NH4+),即:0.4mol/L+2×0.4mol/L=0.4mol/L+c(NH4+),解得:c(NH4+)=0.8mol/L,
故答案为:0.8mol/L;
(2)要求该培养液中c(Cl-)=c(K+)=0.4mol•L-1,c(NH4+)=0.8mol/L,则需要氯化钾的物质的量浓度为0.4mol/L,需要氯化钾固体质量为:m=0.4mol/L×0.5L×74.5g/mol=14.9g;
要使c(SO42-)=0.4mol•L-1,c(NH4+)=0.8mol/L,则需要硫酸铵的物质的量浓度为0.4mol/L,需要硫酸铵固体质量为:m=0.4mol/L×0.5L×132g/mol=26.4g,
故答案为:26.4;
(3)配制含有NH4+、Cl-、K+、SO42-的植物培养液500mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,c(NH4+)=0.8mol/L,需要硫酸钾的物质的量为:$\frac{1}{2}$×0.4mol/L×0.5L=0.1mol,需要硫酸铵的物质的量为:0.4mol/L×0.5L-0.1mol=0.1mol,需要氯化铵的物质的量为:0.8mol/L×0.5L-0.1mol×2=0.2mol;
稀释过程中氯化铵的物质的量不变,则稀释后溶液中氯化铵的物质的量浓度为:$\frac{0.2mol}{0.8L}$=0.25mol/L,
故答案为:0.1mol;0.2mol;0.25mol/L.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题知识点较多,充分考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:推断题
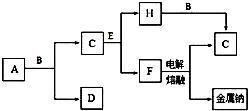 中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
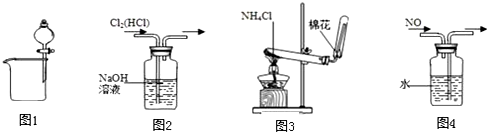
| A. | 图1可用于分离碘酒中的碘和酒精 | B. | 图2可用于除去Cl2中的HCl | ||
| C. | 图3可用于实验室制取氨气 | D. | 图4可用于排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.
某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | O-H |
| 能量(kJ) | 436 | a | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响 | |
| B. | 图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响 | |
| C. | 图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质的数量单位 | |
| B. | 氢气的摩尔质量是2g | |
| C. | 1mol OH-的质量是17g | |
| D. | 气体摩尔体积就是1mol气体所占的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com