
【题目】二氧化硫—空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示。请回答下列问题:
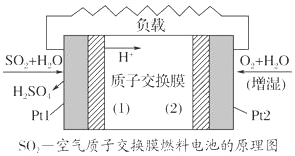
(1)Pt1电极附近发生的反应为______________________________
(2)Pt2电极附近发生的反应为______________________________
(3)该电池放电时电子从______电极经过外电路流到_____电极(填“Ptl”、“Pt2”)。
(4)相同条件下,放电过程中消耗的![]() 和
和![]() 的体积比为_____________。
的体积比为_____________。
【答案】SO2+2H2O2e═SO42+4H+ O2+4H++4e═2H2O Pt1 Pt2 2:1
【解析】
如图所示,由题意该装置为原电池装置,Pt1电极上![]() 转化为硫酸,硫元素化合价升高,失电子,发生氧化反应,Pt1为负极,则Pt2为正极,以此解题。
转化为硫酸,硫元素化合价升高,失电子,发生氧化反应,Pt1为负极,则Pt2为正极,以此解题。
(1)Pt1电极通入SO2,SO2在负极失电子生成SO42,则电极反应为SO2+2H2O2e═SO42+4H+,
答案为:SO2+2H2O2e═SO42+4H+;
(2)酸性条件下,氧气得电子生成水,则Pt2电极附近发生的反应为O2+4H++4e═2H2O,
答案为:O2+4H++4e═2H2O;
(3)原电池放电时,电子从负极流向正极,Pt1电极为负极,Pt2电极为正极,则该电池放电时电子从Pt1电极经过外电路流到Pt2电极,
答案为:Pt1;Pt2;
(4)该电池的原理为二氧化硫与氧气的反应,即2SO2+O2+2H2O=2H2SO4,所以放电过程中消耗的SO2和O2的体积之比为2:1,
答案为:2:1。


科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 触摸试管情况 观察结果 反应完成所需的时间
粉末状 很烫 剧烈反应,带火星的木条复燃 3.5min
块状 微热 反应较慢,火星红亮但木条未复燃 30min
(1)写出上述实验中发生反应的化学方程式: .
(2)实验结果表明,催化剂的催化效果与 有关.
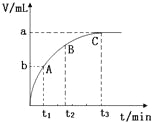
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物及铬合金用途非常广泛。回答下列问题:
⑴基态Cr原子价电子排布式为___;第三电离能I3(Cr)=2987kJ·mol-1,I3(Mn)=3248kJ·mol-1,I3(Cr)<I3(Mn),其原因是___。
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___法区分晶体、准晶体和非晶体。
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为___、___、___。
②写出一种与SCN-互为等电子体的分子:___(填化学式)。
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___,两个配体NH3、SCN-中,中心原子杂化类型依次为___、___。
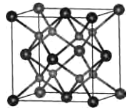
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为___pm,Cr-O键的键长为___pm;设NA为阿伏加德罗常数的值,则CrO2的密度为___g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
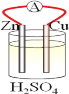
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
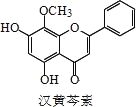
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com