
����Ŀ����15.2 g ͭ��þ��ɵĻ�������250 mL4.0 mol L-1��ϡ�����У�������ȫ�ܽ⣬���ɵ�����ֻ��NO����������Һ�м���1.0 L NaOH��Һ����ʱ��������ǡ�ó�����ȫ����������Ϊ25.4 g������˵������ȷ����
A. ԭ���������У�Cu��Mg�����ʵ���֮��Ϊ2��1
B. ����������Һ��Ũ��Ϊ0.8 mol��L-1
C. �����ܽ�����Һ����������ʵ���Ϊ0.1mol
D. ���ɵ�NO�����ڱ���µ����Ϊ4.48L
���𰸡�C
��������
��15.2 g ͭ��þ��ɵĻ�������250 mL4.0 mol L-1��ϡ�����У�������ȫ�ܽ⣬���ɵ�����ֻ��NO��������Ӧ��3Mg+8HNO3 ��ϡ��=3Mg(NO3)2+2NO��+4H2O��3Cu+8HNO3 ��ϡ��=3Cu(NO3)2+2NO��+4H2O����������Һ�м���1.0 L NaOH��Һ����ʱ��������ǡ�ó�����ȫ��������Ӧ��Mg(NO3)2+2NaOH=Mg(OH)2��+2NaNO3��Cu(NO3)2+2NaOH=Cu(OH)2��+2NaNO3������Ϊ������þ��������ͭ����������Ϊ25.4 g�����ɳ�����������ԭ�Ͻ����������10.2g����������þ��������ͭ����������������Ϊ10.2g�������������ʵ���Ϊ![]() =0.6mol�����ݵ���ת���غ㣬��þ��ͭ���ܵ����ʵ���Ϊ0.3mol�� A����Cu��Mg�����ʵ����ֱ�Ϊx��y�����У�
=0.6mol�����ݵ���ת���غ㣬��þ��ͭ���ܵ����ʵ���Ϊ0.3mol�� A����Cu��Mg�����ʵ����ֱ�Ϊx��y�����У�![]() ����ã�x=0.2mol��y=0.1mol����Cu��Mg�����ʵ���֮��Ϊ2��1��ѡ��A��ȷ��B������ʣ��0.2mol(��ѡ��C����)����μӷ�Ӧ�������Ƶ����ʵ���Ϊ0.2mol+0.6mol=0.8mol����Ҫ����������Һ��Ũ��Ϊ
����ã�x=0.2mol��y=0.1mol����Cu��Mg�����ʵ���֮��Ϊ2��1��ѡ��A��ȷ��B������ʣ��0.2mol(��ѡ��C����)����μӷ�Ӧ�������Ƶ����ʵ���Ϊ0.2mol+0.6mol=0.8mol����Ҫ����������Һ��Ũ��Ϊ![]() =0.8mol/L��ѡ��B��ȷ��C�����ݷ���ʽ��֪�μӷ�Ӧ��n��Ӧ��HNO3��=
=0.8mol/L��ѡ��B��ȷ��C�����ݷ���ʽ��֪�μӷ�Ӧ��n��Ӧ��HNO3��=![]() n��������=0.3mol��
n��������=0.3mol��![]() =0.8mol�������ܽ�����Һ����������ʵ���Ϊ0.25L��4.0mol/L-0.8mol=0.2mol��ѡ��C����ȷ��D�����ݵ���ת���غ��֪���ɵ�NO���ʵ���Ϊ
=0.8mol�������ܽ�����Һ����������ʵ���Ϊ0.25L��4.0mol/L-0.8mol=0.2mol��ѡ��C����ȷ��D�����ݵ���ת���غ��֪���ɵ�NO���ʵ���Ϊ![]() =0.2mol����״���£�����NO�����Ϊ0.2mol��22.4L/mol=4.48L��ѡ��D��ȷ����ѡC��
=0.2mol����״���£�����NO�����Ϊ0.2mol��22.4L/mol=4.48L��ѡ��D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѡ�����л�ѧ��������������������O2��Na2O2��18O��CH3��CH2��CH2��CH2��CH3��O2-��CaCl2 ��O3 ��16O ��NH4Cl ��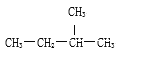
��1��ֻ�����ۼ�����___________________��
��2���Ⱥ����ۼ��ֺ����Ӽ�����___________________��
��3���������Ӿ������______________�����ڹ��ۻ��������_________________��
��4����Ϊͬ�����������______����Ϊͬ���칹�����______����Ϊͬλ�ص���_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�������ͺ�ˮ����75%�ľƾ���Һ�������ˮ��Һ���������ϸ����Һ����ȷ����������
A. ��Һ����ȡ������ B. ��Һ��������ȡ
C. ��ȡ������Һ D. ������ȡ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̶����ܱ������У����еĿ��淴ӦΪA(��) +3B(��)![]() 3C(��)�����������б������淴Ӧһ���ﵽƽ��״̬���ǣ� ��
3C(��)�����������б������淴Ӧһ���ﵽƽ��״̬���ǣ� ��
��C��������ֽ�������� �ڵ�λʱ��������amolA��3amolB
��B��Ũ�Ȳ��ٱ仯 �ܻ�������ܵ����ʵ������ٷ����仯
��A��B��C�����ʵ���֮��Ϊ1��3��3 ���������ܶȲ��ٱ仯
A. �٢ڢ�B. �٢ۢܢ�C. �٢ۢ�D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4L�ܱ������г���6molA�����5molB���壬һ�������·�����Ӧ��3A��g��+B��g��![]() 2C��g��+xD��g�����ﵽƽ��ʱ��������2molC�����ⶨ��D��Ũ��Ϊ0.5mol/L�������ж���ȷ����
2C��g��+xD��g�����ﵽƽ��ʱ��������2molC�����ⶨ��D��Ũ��Ϊ0.5mol/L�������ж���ȷ����
A. B��ת����Ϊ20%
B. ƽ��ʱA��Ũ��Ϊ1.50mol/L
C. x��1
D. �ﵽƽ��ʱ������ͬ�¶��������ڻ�������ѹǿ�Ƿ�Ӧǰ��85%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҳɹ��ϳ������Ϳ�������(��)�����Pt( HPxSC)Cl3����ش��������⣺
(1)��̬��ԭ�Ӽ۵����Ų�ͼΪ__________________��
(2)��Ԫ�����ڱ���,��Ԫ������Ԫ��ͬ�壬��Ԫ��λ��_________��
A.s�� B.p�� C.d�� D. ds�� E.f��
(3)�ס����ȵĵ�һ��������С�����˳��Ϊ__________________(�ѧʽ)��
(4)��Sͬ�������Ԫ���⻯��е���ߵ�Ϊ_________(�ѧʽ),��ԭ��Ϊ_________ ��
(5)��(Pt)���ʾ�����ԭ�ӵĶѻ���ʽ��ͼ��ʾ����ͼ��֪�����岬�Ķѻ���ʽΪ_________��һ�������к���_________����ԭ�ӣ�����ÿ����ԭ������ҵȾ���IJ�ԭ����_________����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڵ�������ܵ������
A.�����Ȼ���
B.����
C.��Ƭ
D.���ڵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AlCl3��һ�ִ�����ijУѧϰС��������װ���Ʊ����ռ�����AlCl3����֪��AlCl3���������е�ˮ����ʱ�ܾ��ҷ�Ӧ����Al(OH)3��HCl��AlCl3��180��ʱ������
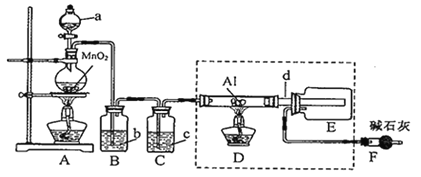
��1��a����������Ϊ_______��Aװ���з�Ӧ�Ļ�ѧ����ʽΪ_______��
��2���Լ�bΪ_______��
��3������d���ܽϴֵ�ԭ����_______��
��4��Fװ�õ�����Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. �Ȼ�����Һ�м��������İ�ˮ��Fe3��+3NH3��H2O == Fe(OH)3��+3NH![]()
B. ������ˮ��Ӧ��Cl2+H2O![]() 2H��+Cl��+ClO��
2H��+Cl��+ClO��
C. �������ᷴӦ����������2Fe+6H�� == 2Fe3��+3H2��
D. BaCl2��Һ��ͨ��SO2��SO2+Ba2++H2O == BaSO3��+2H+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com