
| A. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 | |
| B. | 反应①Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,两反应是相互矛盾的,不可能都发生 | |
| C. | 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO•Al2O3•6SiO2 |
分析 A.硅酸钠不能保存在磨口玻璃塞试剂瓶中;
B.Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓是强酸制弱酸,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,是在高温条件下才能发生;
C、石英玻璃主要成分二氧化硅;
D、根据矿物质用氧化物的形式表示时书写顺序是:活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水来分析.
解答 解:A.硅酸钠属于粘性的物质,能将玻璃塞和试剂瓶粘结在一起而打不开,故A错误;
B.Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓是强酸制弱酸,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,是在高温条件下才能发生,两者不相互矛盾的,都可发生,故B错误;
C、石英玻璃主要成分二氧化硅,是氧化物不是硅酸盐,故C错误;
D、祖母绿的主要成分为Be3Al2Si6O18,用氧化物的形式表示时书写顺序是:活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水,故可以表示为:3BeO•Al2O3•6SiO2,故D正确;
故选D.
点评 本题考查了硅及其化合物和将矿物质的化学式改写为氧化物的方法,难度不大,掌握氧化物的形式表示时书写顺序是:活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质 | |
| B. | 用乙醇从碘水中萃取碘 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用食醋浸泡有水垢的水壶清除其中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol醋酸的质量与NA个醋酸分子的质量相等 | |
| B. | NA个氧气分子和NA个氢气分子的质量比等于16:1 | |
| C. | 30g乙烷(C2H6)所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积约是11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
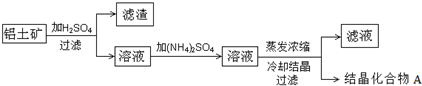
| 实验 | 实验步骤 | 实验结果 |
| ① | 称取9.06g的结晶化合物A加热 | 加热到质量恒定时,质量减轻了4.32g; |
| ② | 将加热后所得的固体分成两等份,分别加适量的水,制成溶液. | |
| ③ | 在一份溶液中加入足量的BaCl2溶液. | 产生4.66g 白色沉淀; |
| ④ | 在另一份溶液中,逐滴加入2mol•L-1的NaOH溶液. | 先观察到产生白色沉淀,接着产生有刺激性气味的气体B,沉淀逐渐溶解,当加入25mL的氢氧化钠溶液时,沉淀恰好完全溶解. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
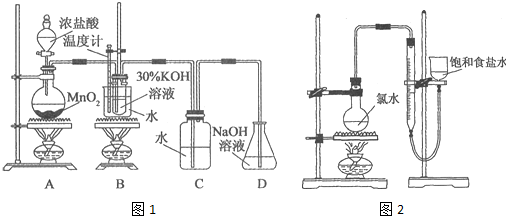
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.2mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
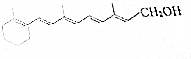 维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.
维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com