
 2CO+O2,达到平衡时体系的平均式量为M,则在相同条件下,可以表示CO2分解率的计算式为
2CO+O2,达到平衡时体系的平均式量为M,则在相同条件下,可以表示CO2分解率的计算式为[ ]
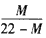
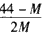
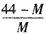
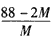
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
| 5 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
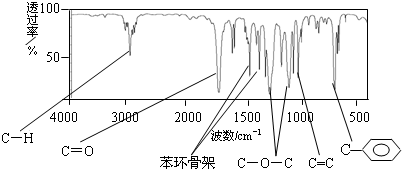


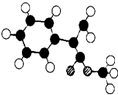




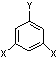 表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:







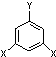 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式:

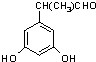



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
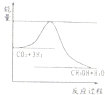
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: 2SO2(g)+O2(g)2SO3(g) ΔH=-196.0kJ·mol-1
2NO(g)+O2(g)2NO2(g) ΔH=-113.0kJ·mol-1
2SO3(l)2SO3(g) ΔH= 20.0 kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式 ;
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为 。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率 (变大、变小或不变)。
查看答案和解析>>
科目:高中化学 来源:天津市南开区2010届高三第一次模拟考试 题型:填空题
乙醇是重要的化工原料和液体燃料,可以利用下列反
应制取乙醇:
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是________________________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
|
|
500 |
600 |
700 |
800 |
||
|
1.5 |
45 |
33 |
20 |
12 |
||
|
2.0 |
60 |
43 |
28 |
15 |
||
|
3.0 |
83 |
62 |
37 |
22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________;平衡常数K______________。(填“增大”、“减小”、或“不变”)
 (4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
影响,并对图中横坐标、纵坐标的含义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇
与氧作用生成水和二氧化碳。该电池的负极反应式为:
___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com