
【题目】向一体积不变的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件.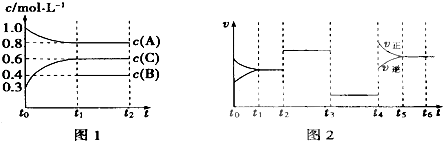
(1)若t1=15min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= .
(2)t3时改变的条件为 , B的起始物质的量为 .
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: .
【答案】
(1)0.02mol/(L?min)
(2)减小压强或取出部分平衡混合气体,1.0mol
(3)2A(g)+B(g)?3C(g)△H=+200aKJ/mol
【解析】解:(1)t0~t1阶段以c的浓度变化表示的反应速率v(C)= ![]() =
= ![]() mol/(L.min)=0.02mol/(L.min);
mol/(L.min)=0.02mol/(L.min);
(2)该反应的反应前后气体体积不变,t3时改变条件反应速率降低,平衡不移动,改变条件是减小压强,也可以取出部分平衡混合气体,其平衡不移动,且反应速率降低;
同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,则B的反应速率= ![]() =
= ![]() ×0.02mol/(L.min),反应开始时A的物质的量为2mol,其浓度为1.0mol/L,则容器体积为2L,
×0.02mol/(L.min),反应开始时A的物质的量为2mol,其浓度为1.0mol/L,则容器体积为2L,
参加反应的B的物质的量n=v△TV= ![]() =
= ![]() ×0.02mol/(L.min)×15min×2L=0.2mol,平衡时B的物质的量=0.4mol/L×2L=0.8mol,则B的物质的量=0.2mol+0.8mol=1.0mol;
×0.02mol/(L.min)×15min×2L=0.2mol,平衡时B的物质的量=0.4mol/L×2L=0.8mol,则B的物质的量=0.2mol+0.8mol=1.0mol;
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,则参加反应的A的物质的量为2mol时吸收热量为200kJ,其热化学反应方程式为2A(g)+B(g)3C(g)△H=+200a KJ/mol;
所以答案是:(1)0.02 mol/(Lmin);(2)减小压强或取出部分平衡混合气体;1.0mol;(3)2A(g)+B(g)3C(g)△H=+200a KJ/mol


科目:高中化学 来源: 题型:
【题目】某液态烃A的分子式为C14H22 , 实验证明它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.该烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则该烃的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年10月12日北京时间上午9时,中国酒泉卫星发射中心成功将“神舟6号”飞船送入太空,这一壮举又一次受到世界关注.火箭推进器中有强还原剂液体肼(N2H4)和强氧化剂液态双氧水.当它们混合时,即产生大量氮气和水蒸气并放出大量热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.
(1)反应的热化学方程
(2)又已知H2O(l)=H2O(g)△H=44kJ.mol﹣1 . 则16g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是 .
(4)燃料电池在航天器得到大量应用;科研人员新近开发出一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,充电一次可供手机连续使用一个月,据此请回答以下问题:
①甲醇是极,电极反应
②电池反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某粗铜产品中含有Zn、Ag、Au等杂质,如图所示,用CH3OH-碱性燃料电池电解硫酸铜溶液。闭合电键K进行电解。下列说法中不正确的是( )
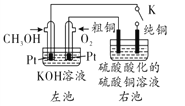
A. 左池负极反应式为CH3OH -6e-+8OH-=CO32-+ 6H2O
B. 通电一段时间后,Ag、Au杂质金属沉积在电解槽底部
C. 若粗铜电极质量减少6.4g,则纯铜电极增重大于6.4g
D. 电解过程中右池纯铜和粗铜分别为阴极和阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族,Y、Z的原子最外层电子数之和等于9,X 的简单氢化物与W的单质组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是
A. 简单离子半径:Y>W>Z
B. W 的氧化物对应的水化物的酸性一定比X 的强
C. Y的简单气态氢化物的热稳定性一定比W的强
D. Y 分别与X、Z形成的化合物,其所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率说法中不正确的是( )
A.反应速率用于衡量化学反应进行的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡状态时,正、逆反应的速率都为0
D.增大反应物的浓度、提高反应温度都能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼巴草的成分之一M具有清炎杀菌作用,M的结构简式如图所示: 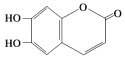 ,下列叙述正确的是( )
,下列叙述正确的是( )
A.M的分子式为C9H6O4
B.1 mol M最多能与2 mol Br2发生反应
C.1 molM最多能与4 mol氢氧化钠反应
D.M既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学在实验室用图甲装置制取乙酸乙酯。回答下列问题:

(1)实验中采用小火加热的目的是__________。
(2)加热A—会儿后,发现忘记加碎瓷片,应采取的正确操作是__________。
(3)浓硫酸的作用是__________。
(4)乙同学采用图乙装罝,图中球形干燥管除起冷凝作用外,另一要重用是__________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(6)下列描述能说明乙醇与乙酸的酯化反应己达到化学平衡状态的有(填序号)____。
①单位时间里生成1mol CH3COOCH2CH3的同时生成1 mol H2O
②单位时间里生成1mol CH3COOCH2CH3的同时消耗1mol CH3COOH
③单位时间里消耗1molCH3CH2OH的同时消耗1 mol CH3COOH
④混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期主族元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,质量数与质子数之差为零。D元素原子的最外层电子数为m,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为![]() 。F与D同主族。请回答下列问题:
。F与D同主族。请回答下列问题:
(1)B元素在周期表中的位置是________。
(2)C与E形成的化合物E3C属于________(填“原子”“离子”或“分子”)晶体。
(3)简单D离子和E离子的半径由大到小____________(填离子符号)
(4)B和D简单气态氢化物的稳定性; _______<_______(填化学式)
(5)F的一种氧化物中氧的质量分数为50%,写出该氧化物与G单质水溶液反应的化学方程式:__________________________________________________。
(6)已知:甲+H2O→丙+丁,该反应不是氧化还原反应。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示,丙具有漂白性。则甲中氯元素的化合价是________,丁与H2O有相同的电子总数,则丁的结构式为________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com