
【题目】某液态烃A的分子式为C14H22 , 实验证明它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.该烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则该烃的结构简式为 .
科目:高中化学 来源: 题型:
【题目】H2在Cl2中燃烧的方程式为:H2 + Cl2 ![]() 2HCl,已知在相同条件下,有下图所示的能量变化,下列说法中正确的是
2HCl,已知在相同条件下,有下图所示的能量变化,下列说法中正确的是
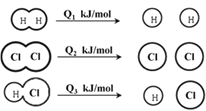
A. H2、Cl2和HCl分子中的化学键都是非极性共价键
B. 1 mol H2与1 mol Cl2的总能量小于2 mol HCl的总能量
C. 1molH2与1molCl2反应生成2 mol HCl时,反应放出的能量为:2Q3-Q1 -Q2
D. 1molH2与1molCl2反应生成2 mol HCl的过程中:Q1+ Q2 >2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物在标准状况下的密度为0.76g/L;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)V元素原子的 L层电子数为______。元素 W 在周期表中的位置为______。
(2)用电子式表示化合物 QZ的形成过程______。
(3)U的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是______。
(4)写出X、Z 两种元素最高价氧化物对应的水化物相互反应的离子方程式:______。
(5)T、U、V形成的氢化物分子中共价键的极性由强到弱的顺序为______。(填化学式)
(6)Q与T可形成一种化合物T2Q4,请写出该分子的结构式________。
(7)元素Y的一种含氧酸化学式为 H3YO3,其结构式可表示为: 。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
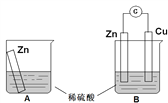
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素的一种化学合成方法的部分工艺流程如图所示: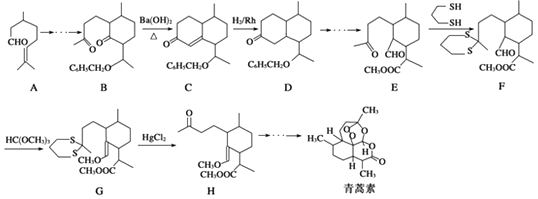
已知,羰基αH可发生下列反应: 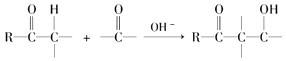 .
.
(1)化合物E中含有的含氧官能团有、和醛基.
(2)合成路线中设计E→F、G→H的目的是 .
(3)反应B﹣→C实际上可看作两步进行,依次发生的反应类型是、 .
(4)A在Snβ沸石作用下,可生成同分异构体异蒲勒醇,已知异蒲勒醇分子中有3个手性碳原子,异蒲勒醇分子内脱水再与1分子H2加成可生成 ![]() ,则异蒲勒醇的结构简式为 .
,则异蒲勒醇的结构简式为 .
(5)写出以苯甲醛和乙烯为原料制备苄基乙醛( ![]() )的合成路线流程图(无机试剂任选).
)的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
Ⅰ | Ⅱ | Ⅲ | |
实验操作 示意图 |
|
|
|
实验现象 | 有极少量气泡产生 | 产生气泡速率略有加快 | 产生气泡速率明显加快 |
(1)实验Ⅰ的作用是_______________。
(2)实验Ⅲ中反应的化学方程式为_______________。
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②_______________。
(4)在一定温度下,10 mL 0.40 mol/L,H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
0~6 min,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。(计算结果精确到0.001)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:2HI(g) ![]() H2(g)+I2(g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
H2(g)+I2(g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
A.HI、H2、I2的浓度相等
B.HI、H2、I2的浓度不再发生变化
C.HI、H2、I2在密闭容器中共存
D.容器内气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“观察DNA和RNA在细胞中的分布”实验中,使用盐酸的目的是 ( )
①改变细胞膜的流动性
②改变细胞膜的通透性
③改变细胞膜的化学组成
④将DNA与蛋白质分离
⑤将RNA与蛋白质分离
⑥利于RNA与染色剂结合
⑦利于蛋白质与染色剂结合
⑧利于DNA与染色剂结合
A.①④⑥ B.②④⑧ C.③⑤⑦ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件.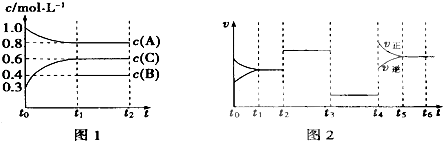
(1)若t1=15min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= .
(2)t3时改变的条件为 , B的起始物质的量为 .
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com