
����Ŀ����֪����������Ԫ��Q��T��U��V��W��X��Y��Zԭ����������������֪��T��U��Vͬ���ڣ�W��X��Y��Zͬ���ڣ�U��Yͬ�壻Ԫ��Q��ij�ֺ���û�����ӣ�Ԫ��T���������������۵Ĵ�����Ϊ0��Q��U�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g/L����ҵ��ͨ������Һ̬�������V�ĵ��ʣ��Ҹõ��ʵ�ij��ͬ���������DZ�������ر���������Ҫ���ϣ�W��X��Z������������Ӧ��ˮ��������֮�䶼�ܷ�Ӧ����W��X��Zԭ������������֮�͵���W��ԭ��������
(1)VԪ��ԭ�ӵ� L�������Ϊ______��Ԫ�� W �����ڱ��е�λ��Ϊ______��
(2)�õ���ʽ��ʾ������ QZ���γɹ���______��
(3)U���⻯���ͬ��������Ԫ�ص��⻯����۷е�����ƫ�ߣ�ԭ����______��
(4)д��X��Z ����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��______��
(5)T��U��V�γɵ��⻯������й��ۼ��ļ�����ǿ������˳��Ϊ______�����ѧʽ��
(6)Q��T���γ�һ�ֻ�����T2Q4����д���÷��ӵĽṹʽ________��
(7)Ԫ��Y��һ�ֺ����ữѧʽΪ H3YO3����ṹʽ�ɱ�ʾΪ�� ������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ______��(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ______��(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
���𰸡� 6 �������ڵڢ�A �� ![]() NH3 ����֮���γ���� Al(OH)3 + 3 H+ =Al3+ + 3H2O H2O> NH3>CH4
NH3 ����֮���γ���� Al(OH)3 + 3 H+ =Al3+ + 3H2O H2O> NH3>CH4 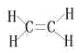 �� H3PO3+2NaOH=Na2HPO3+2H2O
�� H3PO3+2NaOH=Na2HPO3+2H2O
��������Ԫ��Q��ij�ֺ���û�����ӣ���QΪ��Ԫ������ҵ��ͨ������Һ̬�������V�ĵ���,�õ��ʵ�ij��ͬ���������DZ�������ر���������Ҫ����,��VΪ��Ԫ����TԪ����������������֮��Ϊ0��������A����ԭ������С����Ԫ��,��TΪ̼Ԫ����Q��U�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g/L��0.76g/L��22.4L/mol=17g/mol��������ΪNH3����UΪNԪ�أ�U��Yͬ��,��YΪP,W��X��Y��Zͬ���ڣ�W��X��Z������������Ӧ��ˮ��������֮�䶼�ܷ�Ӧ����W��X��Zԭ������������֮�͵���W��ԭ����������WΪNa,XΪAl��ZΪCl,�ݴ˽����
(1) ��Ԫ��ԭ�ӵ� L�������Ϊ6��Ԫ���������ڱ��е�λ��Ϊ�������ڵڢ�A �塣
(2)HClΪ���ۻ�����õ���ʽ��ʾ HCl���γɹ���![]() ��
��
(3) NH3��ͬ��������Ԫ�ص��⻯����۷е�����ƫ�ߣ�ԭ����NH3 ����֮���γ������
(4) X��Z ����Ԫ������������Ӧ��ˮ����ֱ�ΪAl(OH)3��HClO4,���Ӧ�����ӷ���ʽ��Al(OH)3 + 3 H+ =Al3+ + 3H2O��
(5)�ǽ�����Խǿ���γɵ��⻯�ﹲ�ۼ�����Խ������ C��N��O�γɵ��⻯������й��ۼ��ļ�����ǿ������˳��ΪH2O> NH3>CH4 ��
(6)C2H4Ϊ��ϩ����ϩ���ӵĽṹʽΪ��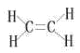 ��
��
(7) �ӽṹʽ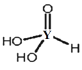 ֪���÷����к��������ǻ��⣬�ʸ���Ϊ2Ԫ�ᣬ�������������������Һ��Ӧ�Ļ�ѧ����ʽΪ��H3PO3+2NaOH=Na2HPO3+2H2O��
֪���÷����к��������ǻ��⣬�ʸ���Ϊ2Ԫ�ᣬ�������������������Һ��Ӧ�Ļ�ѧ����ʽΪ��H3PO3+2NaOH=Na2HPO3+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���CO��g��+2H2��g��CH3OH��g��
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ���� �� ��
A.����CH3OH������������CO���������
B.���������ܶȲ���
C.�����������ƽ��������������
D.CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E.�����ѹǿ���ٸı�
��2�������������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.2mol/L����CO��ת����Ϊ �� ��ʱ���¶�Ϊ ��
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
a������ b��������� c������CO��Ũ�� d�������¼���H2ʹѹǿ���
e�������¼����������ʹѹǿ��� f��������״�
��4����250��ʱ�����ij�ܱ������и����ʵ����ʵ���Ũ�ȼ�����
CO | H2 | CH3OH |
0.5molL��1 | 2molL��1 | 6molL��1 |
��ʱ��Ӧ�������淴Ӧ���ʵĹ�ϵ�ǣ�v������v���棩��������������T������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��F��G��ԭ������������������ֶ�����Ԫ�ء�A��B���γ�B2A��B2A2���ֻ����B��D��G������������Ӧˮ��������֮�䶼�ܷ�Ӧ��D��F��Gԭ������������֮�͵���15���ش��������⣺
��1��EԪ����Ԫ�����ڱ��е�λ����___________��A���ӵĽṹʾ��ͼΪ____________��
��2��D�ĵ�����B������������Ӧˮ�������Һ��Ӧ�������ӷ���ʽΪ________��
��3����B2A2���___________����___________����
�ڸ�������ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ___________________��
��4������˵����ȷ����____________������ĸ��ţ���
��B��D��Eԭ�Ӱ뾶���μ�С
������Ԫ�ص���������ϼ۾�������ԭ�ӵ�����������
��D������������Ӧˮ����������ڰ�ˮ
��Ԫ����̬�⻯����ȶ��ԣ�F��A��G
��5����E��F��G������������Ӧˮ�����У�������ǿ��Ϊ__________���ѧʽ������ԭ�ӽṹ����ԭ��ͬ����Ԫ�ص��Ӳ�����ͬ���������ң�__________���õ�����������ǿ��Ԫ�طǽ���������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֲ�����è��������������������ơ��ڵ���������250������ʷ�ĺ춹ɼ����ѡ2010���������й�����ϡֲ��չ��Ʒ�֡������ں������Ļ�ѧԪ�غ�������Ļ�ѧԪ�طֱ���( )
A. C��O B. C��H C. O��C D. H��O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г��� a~m 13��Ԫ�������ڱ�(��ʡ���˹���Ԫ��)�е�λ�ã�
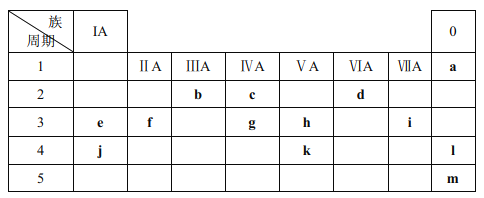
(1)Ԫ�� bΪ______�������ƣ������� g ��ԭ�ӽṹʾ��ͼ______��
(2)Ԫ�� f��i��j ��ԭ�Ӱ뾶�Ӵ�С��˳����______ (��Ԫ�ط��ű�ʾ)��������ԭ�ӷֱ��γɼ����Ӻ����Ӱ뾶�Ӵ�С��˳����______ (�����ӷ��ű�ʾ)��
(3) h �� k ��ԭ���������______ (������)��
(4)Ԫ��d��e�γɵ�һ�ֻ�����Ϊ����ɫ���壬�û�����ĵ���ʽΪ_____________���û������л�ѧ����______���û�������c����������ﷴӦ�Ļ�ѧ����ʽΪ________________________ ��
(5)��������Ϊ�� a��l��m �ĵ��ʲ�������ѧ��Ӧ�� �������ǽ������������塱�� �������������������еĿɲμӻ�ѧ��Ӧ��a��l��m�����п������ȱ����ֿ����γɻ������Ԫ����__________(дԪ�ط���)��
(6)�ø����������京�� 10 ���ӵ� d Ԫ���⻯�����ʱ��һ���������ͷų�һ�����ӣ�ͬʱ����һ�־��н�ǿ�����Ե������ӣ���д���������ӵĵ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п(ZnO)��������1-100 nm֮�䣬��һ������21���͵����߹��ܾ�ϸ����Ʒ�����ֳ�������������ʡ�ij�о����Դ�����п��������CuO��FeO��MnO��Fe2O3�ȣ�Ϊԭ�ϣ�����ʪ��ѧ��(NPP-��)�Ʊ�������������п����������������ͼ��

��֪��
��pH=5.4ʱ��KMnO4�Ļ�ԭ����ΪMnO2��
������ʵ�������¸����������������pH������±���ʾ��
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
��ʼ������pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
������ȫ��pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
����������Ϣ���ش��������⣺
��1�����չ����и�������õ��ķ��뷽����_______________________________��
��2��������1������Ҫ�ɷ���______________________________________________��
��3������Ӧ��2��������������ԭ��Ӧ�����ӷ���ʽΪ_______________________________________________________________
��4�� ����Ӧ��3���м���п�۵�������________________________________��
��5������Ӧ��4���õ��ķ�Һ�У����е���Ҫ���ӳ���Na+�⣬����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1��3������ϩ��һ���ϩ���ܷ��������˫���Ļ��������1��4���ӳɷ�Ӧ�����ɻ�״��������෴Ӧ��Ϊ˫ϩ�ϳɣ����磺
�����к�����д���ʵ��ķ�Ӧ���������Ľṹ��ʽ��������з�Ӧ�Ļ�ѧ����ʽ��
��1��![]() ��
��
��2��+�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijҺ̬��A�ķ���ʽΪC14H22 �� ʵ��֤������ʹ���Ը��������Һ��ɫ��������ʹ��ˮ��ɫ���������ӵ�һ����ԭ�ӱ���ԭ��ȡ��������һ�������2��ͬ���칹�壬������Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2005��10��12�ձ���ʱ������9ʱ���й���Ȫ���Ƿ������ijɹ���������6�š��ɴ�����̫�գ���һ׳����һ���ܵ������ע������ƽ�������ǿ��ԭ��Һ���£�N2H4����ǿ������Һ̬˫��ˮ�������ǻ��ʱ������������������ˮ�������ų������ȣ���֪��0.4molҺ̬����������Һ̬˫��ˮ��Ӧ���ɵ�����ˮ�������ų�256.652kJ��������
��1����Ӧ���Ȼ�ѧ����
��2������֪H2O��l��=H2O��g����H=44kJ��mol��1 �� ��16gҺ̬����������Һ̬˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ�ų���������kJ��
��3���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ��������������һ���ܴ��ŵ��� ��
��4��ȼ�ϵ���ں������õ�����Ӧ�ã�������Ա�½�������һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ����һ�οɹ��ֻ�����ʹ��һ���£��ݴ���ش��������⣺
�ټ״��������缫��Ӧ
�ڵ�ط�Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com