
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.气体的压强不再改变
(2)表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 .
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:
CO | H2 | CH3OH |
0.5molL﹣1 | 2molL﹣1 | 6molL﹣1 |
此时反应的正、逆反应速率的关系是:v(正)v(逆)(填“>”“<”或“═”).
【答案】
(1)C,D,E
(2)80%,250℃
(3)df
(4)<
【解析】解:(1)A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
E.气体的压强不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
(2)平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率= ![]() =
= ![]() =80%,
=80%,
平衡常数K= ![]() =2.04,所以是250℃;
=2.04,所以是250℃;
CO(g)+ | 2H2(g) | CH3OH(g) | |
起始(mol/L) | 1 | 3 | 0 |
转化(mol/L) | 0.8 | 1.6 | 0.8 |
平衡(mol/L) | 0.2 | 1.4 | 0.8 |
(3)a.该反应是放热反应,升高温度平衡向逆反应方向移动,故错误;
b.催化剂对平衡移动无影响,故错误;
c.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故错误;
d.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
e.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故错误;
f.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
(4)当温度为850℃时,反应的平衡常数K=2.041,依据平衡常数概念计算,利用气体反应前后物质的量不变,可以用物质的量代替平衡浓度计算平衡常数,K= ![]() =3>K=2.041,平衡逆向进行,v(正)<v(逆);
=3>K=2.041,平衡逆向进行,v(正)<v(逆);
故答案为:(1)CDE;(2)80%;250℃;(3)df;(4)<
(1)判断一个可逆反应是否达到平衡状态,应判断正逆反应速率是否相等,若相等则达到平衡状态;
(2)根据平衡三段式进行计算;
(3)“要提高CO的转化率”则应使平衡向正反应方向移动;
(4)比较![]() 与平衡常数K的大小,确定反应进行的方向,从而确定正逆反应速率的大小。
与平衡常数K的大小,确定反应进行的方向,从而确定正逆反应速率的大小。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )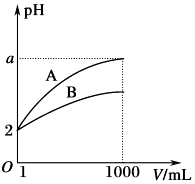
A.A,B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若a小于5,则A,B都是弱酸,且A的酸性弱于B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是

A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
A.碳纳米管表面积大,可用作新型储氢材料
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.CuSO4因具有氧化性,故用其制成的波尔多液可作“杀菌剂”
D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2在Cl2中燃烧的方程式为:H2 + Cl2 ![]() 2HCl,已知在相同条件下,有下图所示的能量变化,下列说法中正确的是
2HCl,已知在相同条件下,有下图所示的能量变化,下列说法中正确的是
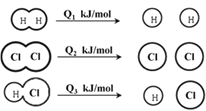
A. H2、Cl2和HCl分子中的化学键都是非极性共价键
B. 1 mol H2与1 mol Cl2的总能量小于2 mol HCl的总能量
C. 1molH2与1molCl2反应生成2 mol HCl时,反应放出的能量为:2Q3-Q1 -Q2
D. 1molH2与1molCl2反应生成2 mol HCl的过程中:Q1+ Q2 >2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物在标准状况下的密度为0.76g/L;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)V元素原子的 L层电子数为______。元素 W 在周期表中的位置为______。
(2)用电子式表示化合物 QZ的形成过程______。
(3)U的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是______。
(4)写出X、Z 两种元素最高价氧化物对应的水化物相互反应的离子方程式:______。
(5)T、U、V形成的氢化物分子中共价键的极性由强到弱的顺序为______。(填化学式)
(6)Q与T可形成一种化合物T2Q4,请写出该分子的结构式________。
(7)元素Y的一种含氧酸化学式为 H3YO3,其结构式可表示为: 。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com