
【题目】下表列出了 a~m 13种元素在周期表(已省略了过渡元素)中的位置:
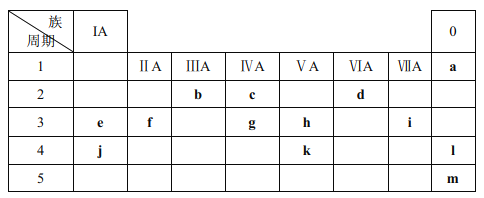
(1)元素 b为______(填名称);画出 g 的原子结构示意图______。
(2)元素 f、i、j 的原子半径从大到小的顺序是______ (用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是______ (用离子符号表示)。
(3) h 和 k 的原子序数相差______ (填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有______,该化合物与c的最高价氧化物反应的化学方程式为________________________ 。
(5)人们曾认为, a、l、m 的单质不发生化学反应, 曾把它们叫做“惰性气体”。 但后来发现这族气体有的可参加化学反应,a、l、m中最有可能首先被发现可以形成化合物的元素是__________(写元素符号)。
(6)用高能射线照射含有 10 电子的 d 元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:______。
【答案】 硼 略 K、 Mg 、Cl Cl- 、K+ 、Mg2+ 18  离子键、(非极性)共价键 2Na2O2 + 2CO2 = 2Na2CO3+ O2 Xe 略
离子键、(非极性)共价键 2Na2O2 + 2CO2 = 2Na2CO3+ O2 Xe 略
【解析】由元素在周期表中的位置可以知道a、b、c、d、e、f、g、h、i、j、k、l、m分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe等元素,(1)b在第2周期IIA族为硼,g在第3周期IVA族为硅;(2) 同周期从左到右原子半径逐渐减小;同周期阴离子半径大于阳离子半径,核外电子排布相同的离子,核电荷数越大,离子半径越小;(3)P在第3周期VA族,As在第4周期VA族;(4)过氧化钠为淡黄色固体,为含有共价键的离子化合物,过氧化钠和二氧化碳反应生成碳酸钠和氧气;(5)同族元素从上到下金属逐渐增强,和F2更容易反应;(6) 用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为:![]() 。
。
由元素在周期表中的位置可以知道a、b、c、d、e、f、g、h、i、j、k、l、m分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe等元素,
(1)元素 b为硼; g 的原子结构示意图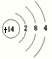 。故答案为:硼 ;
。故答案为:硼 ; 。
。
(2)元素 f、i、j 的原子半径从大到小的顺序是K、 Mg 、Cl;这三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl- 、K+ 、Mg2+。故答案为:K、 Mg 、Cl; Cl- 、K+ 、Mg2+
(3) P在第3周期VA族,As在第4周期VA族, P 和 As 的原子序数相差18。
(4)元素O和Na形成的一种化合物为淡黄色固体为过氧化钠,过氧化钠的电子式为 ,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3+ O2。
,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3+ O2。
(5)根据同族元素性质递变规律,He、Kr、Xe中最有可能首先被发现可以形成化合物的元素是Xe。
(6) 用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为:![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明的妈妈在超市购买了面粉、牛肉、桔子和梅子蜜饯,要求小明根据所学知识说出每种食品中所含的一类营养物质.下面是小明的回答,其中错误的是( )
A.面粉﹣淀粉
B.牛肉﹣蛋白质
C.桔子﹣维生素
D.梅子蜜饯﹣防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是( )
A.苯酚钠溶液中通入少量CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣ ![]() HCOO﹣+NH4++2Ag↓+3NH3+H2O
HCOO﹣+NH4++2Ag↓+3NH3+H2O
C.1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH ![]() CH3CH=CH2↑+NaCl+H2O
CH3CH=CH2↑+NaCl+H2O
D.向小苏打溶液中加入醋酸:HCO3﹣+CH3COOH═CO2↑+H2O+CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 100g 质量分数为 46%的乙醇(C2H5OH)溶液中含氧原子总数为 4NA
B. 标准状况下, 2.24 L CCl4 含有的共价键数为 0.4NA
C. 1 L 0.1 mol·L-1 的乙酸(CH3COOH)溶液中含 H+的数量为 0.1NA
D. 235g核素23592U发生裂变反应: ![]() ,净产生的中子(
,净产生的中子(![]() )数为10NA
)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物在标准状况下的密度为0.76g/L;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)V元素原子的 L层电子数为______。元素 W 在周期表中的位置为______。
(2)用电子式表示化合物 QZ的形成过程______。
(3)U的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是______。
(4)写出X、Z 两种元素最高价氧化物对应的水化物相互反应的离子方程式:______。
(5)T、U、V形成的氢化物分子中共价键的极性由强到弱的顺序为______。(填化学式)
(6)Q与T可形成一种化合物T2Q4,请写出该分子的结构式________。
(7)元素Y的一种含氧酸化学式为 H3YO3,其结构式可表示为: 。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式______。(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4环己二酮单乙二醇缩酮)为原料合成(如图).下列说法不正确的是( )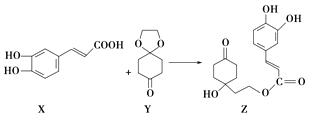
A.X的分子式为C9H8O4
B.Y、Z中均含1个手性碳原子
C.Z能发生加成反应、取代反应及消去反应
D.1 mol Z至多可与3 mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素的一种化学合成方法的部分工艺流程如图所示: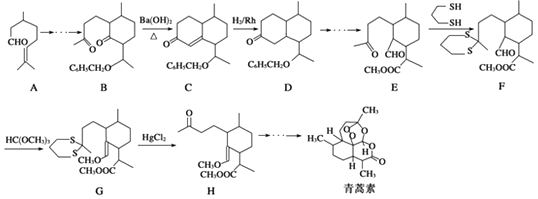
已知,羰基αH可发生下列反应: 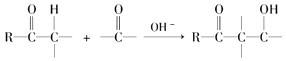 .
.
(1)化合物E中含有的含氧官能团有、和醛基.
(2)合成路线中设计E→F、G→H的目的是 .
(3)反应B﹣→C实际上可看作两步进行,依次发生的反应类型是、 .
(4)A在Snβ沸石作用下,可生成同分异构体异蒲勒醇,已知异蒲勒醇分子中有3个手性碳原子,异蒲勒醇分子内脱水再与1分子H2加成可生成 ![]() ,则异蒲勒醇的结构简式为 .
,则异蒲勒醇的结构简式为 .
(5)写出以苯甲醛和乙烯为原料制备苄基乙醛( ![]() )的合成路线流程图(无机试剂任选).
)的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1828年,德国化学家弗里德里希·维勒首次使用(NH4)2SO4与氰酸钾KCNO人工合成了尿素CO(NH2)2,打破了有机化合物的"生命力"学说。
(1) (NH4)2SO4与KCNO合成尿素反应的化学方程式为____________。
(2)某小组同学在实验室条件下,拟用CO2和NH3,在催化剂的作用下合成尿素。
①用CO2和NH3合成尿素 CO(NH2)2反应的化学方程式为____________。
②实验所需的CO2可用多种装置来制备,要想达到“随开随用、随关随停”的目的,下列装置A、B、C、D、E中符和要求的有____________(填字母)。
③若用F装置收集氨气,则气体应由导管口____________(填“a”或“b”)进入。




(3)尿素样品中氮含量可以用甲醛法标定,其原理如下:首先用浓硫酸分解试样,使试液中的胺生成硫酸铵并放出二氧化碳;将过量的硫酸中和后得到中性铵盐,再用甲醛(HCHO)与硫酸铵作用生成六次甲基四铵盐离子(CH2)6N4H+和硫酸;最后用标准氢氧化钠溶液滴定。
①甲醛与硫酸铵反应的离子方程式为____________;
②滴定选用的指示剂为____________。滴定终点的现象为____________。
③若称取样品m g,溶解后配成250mL溶液。取25.00mL样品溶液于250 mL锥形瓶中,加入10mL w%的甲醛溶液,充分反应后,加入1~2滴指示剂,用浓度为a mol/L的NaOH标准溶液滴定至终点(已知滴定时,1 mol六次甲基四铵盐离子(CH2)6N4H+消耗OH﹣的能力与1mol H+相当)。重复2次,消耗NaOH标准溶液的体积平均值为b mL。则该样品中氮的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com