
【题目】青蒿素的一种化学合成方法的部分工艺流程如图所示: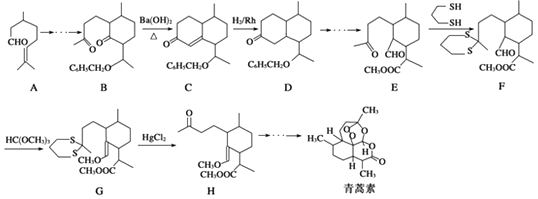
已知,羰基αH可发生下列反应: 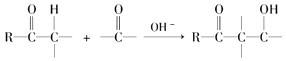 .
.
(1)化合物E中含有的含氧官能团有、和醛基.
(2)合成路线中设计E→F、G→H的目的是 .
(3)反应B﹣→C实际上可看作两步进行,依次发生的反应类型是、 .
(4)A在Snβ沸石作用下,可生成同分异构体异蒲勒醇,已知异蒲勒醇分子中有3个手性碳原子,异蒲勒醇分子内脱水再与1分子H2加成可生成 ![]() ,则异蒲勒醇的结构简式为 .
,则异蒲勒醇的结构简式为 .
(5)写出以苯甲醛和乙烯为原料制备苄基乙醛( ![]() )的合成路线流程图(无机试剂任选).
)的合成路线流程图(无机试剂任选).
【答案】
(1)酯基,羰基
(2)保护羰基
(3)加成反应,消去反应
(4)![]()
(5)![]()
【解析】解:(1)根据E的结构可知,含有的含氧官能团为酯基、醛基、羰基;
(2)由E→F的结构可知,羰基中C=O双键变成C﹣S单键,由G→H的结构可知C﹣S单键又变成羰基,目的是保护羰基;
(3)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α﹣H与C=O先发生发生加成反应产生C﹣OH,再发生消去反应生成产生C=C双键生成C;
(4)由最终分子的结合,结合异蒲勒醇分子有3个手性碳原子、与A互为同分异构体,可知其结构为环状,分子内脱水,应含有﹣OH,根据A的结合可知﹣OH处于环中甲基的间位位置,结合加成产物 ![]() 可知应是异蒲勒醇与氢气发生1,4﹣加成,则异蒲勒醇的结构简式为:
可知应是异蒲勒醇与氢气发生1,4﹣加成,则异蒲勒醇的结构简式为: ![]() ;
;
(5)结合流程中B→C→D的变化分析设计,乙烯在催化剂加热条件下与水反应生成乙醇,乙醇催化氧化生成乙醛,乙醛与苯甲醛在氢氧化钡条件下生成 ![]() ,在氢气/Rh条件下发生加成反应生成
,在氢气/Rh条件下发生加成反应生成 ![]() ,
,
工艺流程图为: ![]() ;
;
所以答案是:(1)酯基、羰基;(2)保护羰基;(3)加成反应、消去反应;(4)![]() (5)
(5)![]()


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.2,2﹣二甲基﹣1﹣丁醇与2﹣甲基﹣2﹣丁醇互为同分异构体
B.![]() 的核磁共振氢谱有5个峰
的核磁共振氢谱有5个峰
C.根据核磁共振氢谱能鉴别1﹣溴丙烷和2﹣溴丙烷
D.用KMnO4酸性溶液能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了 a~m 13种元素在周期表(已省略了过渡元素)中的位置:
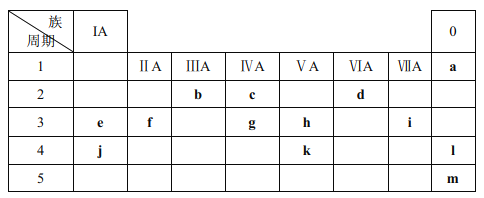
(1)元素 b为______(填名称);画出 g 的原子结构示意图______。
(2)元素 f、i、j 的原子半径从大到小的顺序是______ (用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是______ (用离子符号表示)。
(3) h 和 k 的原子序数相差______ (填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有______,该化合物与c的最高价氧化物反应的化学方程式为________________________ 。
(5)人们曾认为, a、l、m 的单质不发生化学反应, 曾把它们叫做“惰性气体”。 但后来发现这族气体有的可参加化学反应,a、l、m中最有可能首先被发现可以形成化合物的元素是__________(写元素符号)。
(6)用高能射线照射含有 10 电子的 d 元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1,3﹣丁二烯的一类二烯烃能发生与具有双键的化合物进行1,4﹣加成反应,生成环状化合物,这类反应称为双烯合成,例如:
在下列横线上写出适当的反应物或生成物的结构简式,完成下列反应的化学方程式:
(1)![]() →
→
(2)+→ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃A的分子式为C14H22 , 实验证明它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.该烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则该烃的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成(部分反应条件略去);

(1)阿塞那平中的含氧官能团为_______(填官能团的名称)。由F→阿塞那平的反应类型为______________。
(2)化合物X的分子式为C4H9NO2,则由B→C反应的另一产物的化学式_______________________。
(3)由D生成E的过程中先后发生加成反应和消去反应,则加成反应后中间体的结构简式为____________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:________。
I.属于芳香化合物,分子中含有5种不同化学环境的氢;
II.能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(5)已知: ![]() ,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、CH3NH2和
,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、CH3NH2和![]() 为原料制备
为原料制备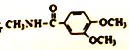 的合成路线流程图(无机试剂任用)。_____________
的合成路线流程图(无机试剂任用)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
(1)自18世纪以来,科学家们不断探索元素之谜。通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
序号 | ① | ② | ③ | ④ |
科学 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
上述科学家的研究按照时间先后排序合理的是_________(填数字序号)。
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
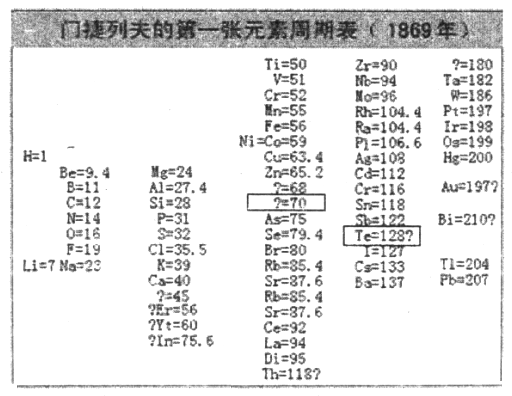
①门捷列夫将已有元素按照相对原子质量排序,同一___________(填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是_______________,第5列方框中“Te=128?”的问号表达的含义是_______________。
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是_______________(填字母序号)。
A. 随着核电荷数递增,原子核外电子排布呈现周期性变化
B. 随着核电荷数递增,原子半径呈现周期性变化
C. 随着核电荷数递增,元素主要化合价呈现周期性变化
(3)短周期元素A、B、D、E、G、J在周期表中的位置如下:
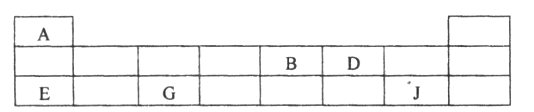
根据上表回答问题:
①D在周期表中的位置是_______________。
②A、B、E、G的原子半径由大到小的顺序是_______________(填元素符号)。
③B、D的气态氢化物的稳定性大小关系为_______________(填化学式)。
④E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为i. H++OH-=H2O、ii. _______________、iii_______________。
⑤用电子式表示E的最高价氧化物的形成过程_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族,Y、Z的原子最外层电子数之和等于9,X 的简单氢化物与W的单质组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是
A. 简单离子半径:Y>W>Z
B. W 的氧化物对应的水化物的酸性一定比X 的强
C. Y的简单气态氢化物的热稳定性一定比W的强
D. Y 分别与X、Z形成的化合物,其所含化学键的类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com