
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
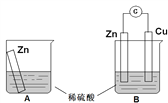
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
【答案】 Zn + 2H+ === Zn2+ + H2↑ 负 Zn - 2e- === Zn2+ 有大量无色气泡产生 2H+ + 2e- === H2↑ 大于 热能 电能 ABD
【解析】(1)A烧杯中锌与稀硫酸反应的离子方程式为Zn + 2H+ === Zn2+ + H2↑,故答案为:Zn + 2H+ === Zn2+ + H2↑;
(2)B中锌比铜活泼,Zn板是负极,发生的电极反应是Zn - 2e- === Zn2+,Cu板上氢离子放电生成氢气,电极反应为2H+ + 2e- === H2↑,现象为有大量无色气泡产生,故答案为:负;Zn - 2e- === Zn2+;有大量无色气泡产生;2H+ + 2e- === H2↑;
(3)从能量转化的角度来看,锌与稀硫酸的反应属于放热反应,反应物的总能量大于生成物总能量,A中是将化学能转变为热能,B中主要是将化学能转变为电能,故答案为:大于;热能;电能;
(4)A.原电池反应是一个氧化还原反应,一定有电子转移,故A正确;B.根据原电池的构成条件,原电池装置需要2个电极,故B正确;C.根据题意,锌被逐渐溶解,参加了反应,故C错误;D.根据原电池原理,氧化反应和还原反应可以拆开在两极发生,从而产生电流,故D正确;故选ABD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A. 用规格为10mL的量筒量取6.20mL的液体
B. 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘
C. 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质
D. 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳和硫的化合物的性质,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品。
I. (1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) +CO2(g)===2Fe3O4(s)+C(s) ΔH=-76.0 kJ·mol-1
①上述反应的还原产物为 ,每生成1 mol Fe3O4,转移电子的物质的量为________mol;
②已知:C(s) +2H2O(g)===CO2(g)+2H2(g) ΔH=+113.4 kJ·mol-1,则反应:
3FeO(s) +H2O(g)===Fe3O4(s)+H2(g)的 ΔH=________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L-1,H2 0.8 mol·L-1,CH4 0.8 mol·L-1,H2O 1.6 mol·L-1。则300℃时上述反应的平衡常数K=________。200℃时该反应的平衡常数K=64.8,则该反应的ΔH________(填“>”或“<”)0。
CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L-1,H2 0.8 mol·L-1,CH4 0.8 mol·L-1,H2O 1.6 mol·L-1。则300℃时上述反应的平衡常数K=________。200℃时该反应的平衡常数K=64.8,则该反应的ΔH________(填“>”或“<”)0。
Ⅱ. SO2直接排放会对环境造成危害。SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③能说明上述反应达到平衡状态的是 。
a. SO2 的消耗速率与CO2 的生成速率相同 b. 混合气体的密度不变
c. S2的浓度不变 d. SO2 与S2的物质的量之比为2:1
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.c(Na+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
c.c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )
)
d.水电离出c(H+)=1×10-8 mol/L
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的电极反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103 mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
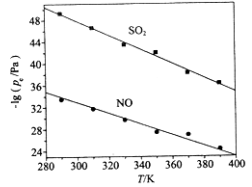
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:

请参照元素①一⑨在周期表表中的位置,用化学用语回答下列问题:
(1)写出元素⑥在周期表中的位置是____________。
(2)元素⑤、⑧、⑨的离子半径由大到小的顺序为______________。
(3)元素①④⑨形成原子个数比1:1:1化合物的电子式为_________;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:_________________。
(4)元素⑤和⑥最高价氧化物水化物反应的离子方程式为_______________。
(5)②的单质与⑧的最高价氧化物水化物浓溶液反应的化学方程式为______________________,若反应中有6.02×1023个电子发生转移,则生成的气体标准状况下的体积为______L。
(6)写出一个方程式,证明元素⑧的非金属性比元素⑨弱:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
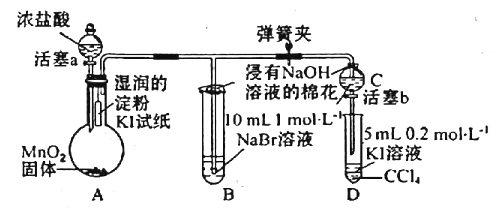
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为_________________,在该反应中浓盐酸表现了____性。
(2)验证氯气的氧化性强于碘的实验现象是____________________。
(3)B中溶液发生反应的离子方程式是____________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____________________。
(5)浸有NaOH溶液的棉花作用是____;离子方程式为____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:![]()
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol/L。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com