
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
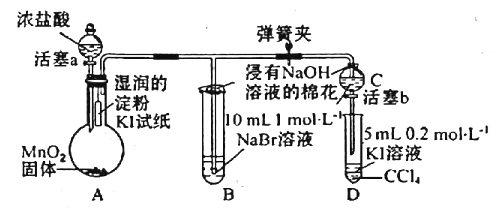
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为_________________,在该反应中浓盐酸表现了____性。
(2)验证氯气的氧化性强于碘的实验现象是____________________。
(3)B中溶液发生反应的离子方程式是____________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____________________。
(5)浸有NaOH溶液的棉花作用是____;离子方程式为____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____,得电子能力逐渐减弱。
【答案】 MnO2 + 4H+ + 2Cl-![]() Mn2+ + Cl2↑+ 2H2O 酸性、还原性 湿润的淀粉KI试纸变蓝 Cl2 + 2Br—==2Cl—+ Br2 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 吸收尾气,防止氯气污染空气 Cl2 + 2OH- == Cl- + ClO- + H2O 原子半径逐渐增大
Mn2+ + Cl2↑+ 2H2O 酸性、还原性 湿润的淀粉KI试纸变蓝 Cl2 + 2Br—==2Cl—+ Br2 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 吸收尾气,防止氯气污染空气 Cl2 + 2OH- == Cl- + ClO- + H2O 原子半径逐渐增大
【解析】(1)A中属于二氧化锰与盐酸制备氯气,反应的方程式为MnO2 + 4H+ + 2Cl-![]() Mn2+ + Cl2↑+ 2H2O。反应中还有氯化锰生成,则浓盐酸表现出酸性和还原性;(2)淀粉变蓝色,说明有单质碘生成,也说明氯气氧化性强于单质碘。(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-=Br2+2Cl-。(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色。因此实验操作为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色;(5)为氯气有毒,需要尾气处理,反应的方程式为Cl2 + 2OH-=Cl- + ClO- + H2O。(6)同主族元素从上到下原子半径逐渐增大,得电子能力逐渐减弱
Mn2+ + Cl2↑+ 2H2O。反应中还有氯化锰生成,则浓盐酸表现出酸性和还原性;(2)淀粉变蓝色,说明有单质碘生成,也说明氯气氧化性强于单质碘。(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-=Br2+2Cl-。(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色。因此实验操作为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色;(5)为氯气有毒,需要尾气处理,反应的方程式为Cl2 + 2OH-=Cl- + ClO- + H2O。(6)同主族元素从上到下原子半径逐渐增大,得电子能力逐渐减弱


科目:高中化学 来源: 题型:
【题目】已知钍![]() 的原子可发生下列放射性变化:
的原子可发生下列放射性变化: ![]() →
→![]() +
+ ![]()
A. X的氢氧化物是一种强碱 B. X元素位于第六周期
C. X的碳酸盐难溶于水 D. X的最高化台价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应在一定条件下达到化学平衡时,下列说法不正确的是
A. 正反应速率等于逆反应速率 B. 反应物和生成物浓度不再发生变化
C. 反应体系中混合物的组成保持不变 D. 正、逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮食是保证我们身体健康的基本需求,下列关于饮食的说法正确的是
A. 鸡蛋含有丰富的蛋白质,人类需要的蛋白质都可以由鸡蛋提供,多吃有益
B. 水果、蔬菜含有丰富的维生素,有人为了减肥,每天只吃水果蔬菜即可
C. 米饭含有大量的淀粉,成人每天食用量不能超过200g。
D. 要促进身体健康,各种食物必须合理搭配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
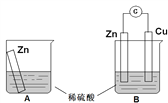
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色 ④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.都能证明 B.都不能证明
C.③④⑤能证明 D.只有⑤能证明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
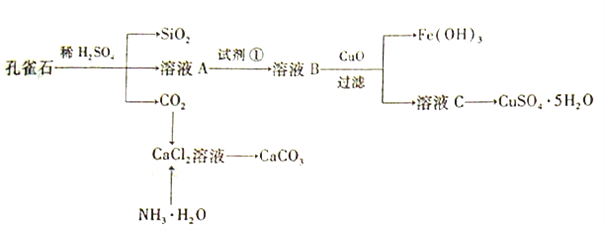
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为____(填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、__________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是______。
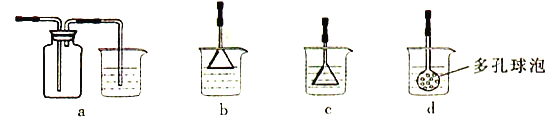
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)___________(填化学式),若实验过程中有氨气逸出,应选用下列______装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应____,直到_____,用KMnO4标准溶液滴定时应选用____滴定管(填“酸式”或“碱式”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com