
����Ŀ���±�ΪԪ�����ڱ���һ���֣�

�����Ԫ�آ�һ�������ڱ����е�λ�ã��û�ѧ����ش��������⣺
(1)д��Ԫ�آ������ڱ��е�λ����____________��
(2)Ԫ�آݡ��ࡢ������Ӱ뾶�ɴ�С��˳��Ϊ______________��
(3)Ԫ�آ٢ܢ��γ�ԭ�Ӹ�����1:1:1������ĵ���ʽΪ_________��д��Ԫ�آݺ͢��γ�ԭ�Ӹ�����2��1��������γɹ��̣�_________________��
(4)Ԫ�آݺ͢����������ˮ���ﷴӦ�����ӷ���ʽΪ_______________��
(5)�ڵĵ����������������ˮ����Ũ��Һ��Ӧ�Ļ�ѧ����ʽΪ______________________������Ӧ����6.02��1023�����ӷ���ת�ƣ������ɵ������״���µ����Ϊ______L��
(6)д��һ������ʽ��֤��Ԫ�آ�ķǽ����Ա�Ԫ�آ�����____________________��
���𰸡� �������ڵڢ�A�� S2- >Cl- >Na+ ![]()
![]() Al(OH)3 + OH- ==Al3+ + 2H2O C + 2H2SO4 (Ũ)
Al(OH)3 + OH- ==Al3+ + 2H2O C + 2H2SO4 (Ũ)![]() CO2 ��+ 2SO2 ��+ 2H2O 16.8 Cl2 + H2S =S�� + 2HCl
CO2 ��+ 2SO2 ��+ 2H2O 16.8 Cl2 + H2S =S�� + 2HCl
������������Ԫ�������ڱ����е�λ�ÿ�֪�ֱ��Ǣ���H������C������O������Na������Al������Si������S������Cl����
(1)��Ԫ��ԭ��������13�������ڱ��е�λ���ǵ������ڵڢ�A�塣(2)���ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С����Ԫ�آݡ��ࡢ������Ӱ뾶�ɴ�С��˳��ΪS2- >Cl- >Na+��(3)Ԫ�آ٢ܢ��γ�ԭ�Ӹ�����1:1:1�������ǹ��ۻ���������ᣬ�����ʽΪ![]() ��Ԫ�آݺ͢��γ�ԭ�Ӹ�����2��1�����������ӻ��������ƣ��γɹ���Ϊ
��Ԫ�آݺ͢��γ�ԭ�Ӹ�����2��1�����������ӻ��������ƣ��γɹ���Ϊ![]() ��(4)Ԫ�آݺ͢����������ˮ�������������ƺ��������������߷�Ӧ�����ӷ���ʽΪAl(OH)3 + OH-��Al3+ + 2H2O��(5)�ڵĵ���̼�������������ˮ����Ũ��ҺŨ���ᷴӦ�Ļ�ѧ����ʽΪC + 2H2SO4 (Ũ)
��(4)Ԫ�آݺ͢����������ˮ�������������ƺ��������������߷�Ӧ�����ӷ���ʽΪAl(OH)3 + OH-��Al3+ + 2H2O��(5)�ڵĵ���̼�������������ˮ����Ũ��ҺŨ���ᷴӦ�Ļ�ѧ����ʽΪC + 2H2SO4 (Ũ)![]() CO2 ��+ 2SO2 ��+ 2H2O������Ӧ����6.02��1023�����Ӽ�1mol���ӷ���ת�ƣ�������0.25molCO2��0.5molSO2�������״���µ����Ϊ0.75mol��22.4L/mol��16.8L��(6)�����ܰ���������Ϊ����S��˵����Ԫ�طǽ�����ǿ����Ԫ�أ���Ӧ�ķ���ʽΪCl2+H2S��S��+ 2HCl��
CO2 ��+ 2SO2 ��+ 2H2O������Ӧ����6.02��1023�����Ӽ�1mol���ӷ���ת�ƣ�������0.25molCO2��0.5molSO2�������״���µ����Ϊ0.75mol��22.4L/mol��16.8L��(6)�����ܰ���������Ϊ����S��˵����Ԫ�طǽ�����ǿ����Ԫ�أ���Ӧ�ķ���ʽΪCl2+H2S��S��+ 2HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ijͬѧΪ̽��Ԫ�����ڱ���ͬ����Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮

��1�����ơ�þ������1 mol�ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ������________�����ᷴӦ����ң� ________�����ᷴӦ������������࣮
��2����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ__________��
��.������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯����
��3�������D�������� ��
��4����Ҫ֤���ǽ����ԣ�Cl>I����A�м�Ũ���ᣬB�м�KMnO4��(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ ������ ����֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã����� ��Һ����β����
��5����Ҫ֤���ǽ����ԣ�C>Si������A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ���۲쵽C����Һ ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ���C�и���ʵ�飬Ӧ����װ�ü�����װ�� ��Һ��ϴ��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ĸ�Ч���öԱ����������ٽ����ó���������չ������Ҫ���á���β����Ҫ��Ca5(PO4)3F��CaCO3��MgCO3 ��ij�о�С���������β���ۺ����õ��о��������Ʊ�������Ҫ��ҵ��;��CaCO3��Mg(OH)2��P4��H2������������£�

��֪����Ca5(PO4)3F��950�治�ֽ⣻
��4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
��ش��������⣺
��1��950��������β�������������Ҫ�ɷ���___________��
��2��ʵ���ҹ�������IJ���������_____________��
��3��NH4NO3��Һ�ܴ�����н�ȡ��Ca2+��ԭ����__________��
��4���ڽ�ȡҺ����ͨ��NH3��������Ӧ�Ļ�ѧ����ʽ��____________��
��5����ҵ�ϳ�������[Ca5(PO4)3F]�����ᷴӦ�Ʊ����ᡣ��֪25�棬101kPaʱ��
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ��H=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ��H=-937kJ/mol
��Ca5(PO4)3F�����ᷴӦ����������Ȼ�ѧ����ʽ��_________________��
��6����һ��������CO(g)+H2O(g) ![]() CO2(g)+H2(g)����CO��H2O(g)����ʼ���ʵ���֮��Ϊ1:5����ƽ��ʱ��COת����
CO2(g)+H2(g)����CO��H2O(g)����ʼ���ʵ���֮��Ϊ1:5����ƽ��ʱ��COת����![]() ����a kg��Ca5(PO4)3F����Է�������Ϊ504������������Ϊ10%����β����������������b%��Ca5(PO4)3Fת��ΪP4����������CO��H2O(g)����ʼ���ʵ���֮��1:3��ϣ�����ͬ�����´�ƽ��ʱ�ܲ���H2________kg��
����a kg��Ca5(PO4)3F����Է�������Ϊ504������������Ϊ10%����β����������������b%��Ca5(PO4)3Fת��ΪP4����������CO��H2O(g)����ʼ���ʵ���֮��1:3��ϣ�����ͬ�����´�ƽ��ʱ�ܲ���H2________kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ���ǣ� ��
A.NH3��������ˮ�������ڹ�ҵ�����
B.HNO3�������ԣ��������Ʊ�������ԭ��
C.NH4 NO3������ˮ��������������²���
D.N2������ˮ�������ںϳɰ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(LiBH4)��һ����Ҫ�Ļ�ѧ�Լ��������¿��� HCl ���巢�����·�Ӧ��
2LiBH4 + 2 HCl![]() 2 LiCl + B2H6 + 2 H2
2 LiCl + B2H6 + 2 H2
�÷�Ӧ�У�LiBH4��B2H6 �е���Ԫ�ؾ��ԣ�1�ۡ� ��ش��������⡣
(1)LiBH4 ����Ԫ�صĻ��ϼ�Ϊ________��
(2)�÷�Ӧ�Ļ�ԭ��Ϊ________��4 mol LiBH4 ��ȫ��Ӧ��ʧȥ________mol ���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��������ͼ��ʾװ��A��B�ֱ�̽������п��ϡ����ķ�Ӧ��ʵ�������A�ձ��ڵ���Һ�¶����ߣ�B�ձ��ĵ�����ָ�뷢��ƫת����ش��������⡣
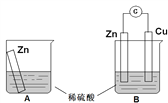
��1��A�ձ��з�Ӧ�����ӷ���ʽΪ_________��
��2��B��Zn����_________���������ĵ缫��Ӧ��_________��Cu���ϵ�������_________�������ĵ缫��Ӧ��_________��
��3��������ת���ĽǶ�������A��B�з�Ӧ���������_________������ڡ�����С�ڡ����ڡ�����������������A���ǽ���ѧ��ת��Ϊ_________��B����Ҫ�ǽ���ѧ��ת��Ϊ_________��
��4����С��ͬѧ��˼ԭ��ص�ԭ�������й۵���ȷ����_________������ĸ��ţ���
A��ԭ��ط�Ӧ�Ĺ�����һ���е���ת��
B��ԭ���װ����Ҫ2���缫
C���缫һ�����ܲμӷ�Ӧ
D��������Ӧ�ͻ�ԭ��Ӧ���Բ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���£�H2N��NH2����һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol��ѧ�������������kJ����N��NΪ942��O=OΪ500��N��NΪ154�������1molN��H�������������kJ���ǣ� ��

A��194 B��391 C��516 D��658
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������彡��������˵������ȷ����(����)
A. ��Ȫˮ���ж�����Ԫ�������������������彡��
B. Ӫ��ǿ�����Ե�Խ��Խ��
C. ����ѡ����ʳ����ȷʹ��ҩ�������彡���ı�֤
D. �ֱ���ʳƷ���ǷǴ���ҩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮע��KI��Һ�У�����ַ�Ӧ����CCl4���������ú�ɹ۲쵽�� ��
A.Һ��ֳ����㣬�²����ɫ
B.Һ��ֳ����㣬�ϲ����ɫ
C.���Һ���ֲ㣬����ɫ��
D.���Һ���ֲ㣬�ҳʺ�ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com