
【题目】Fe2+、Fe3+与O22-、CN-、F-有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(2)Fe2+基态核外电子排布式为_____________________________。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。
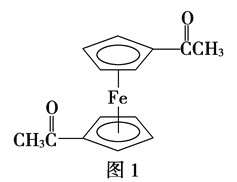
此物质中碳原子的杂化方式是______________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________。已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为_____________。
(5)F-不仅可与Fe3+形成[FeF6]3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。
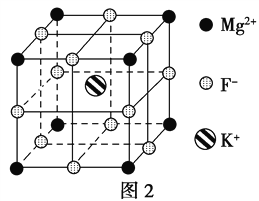
该晶体的化学式为___________________________________。
【答案】N>O>C 1s22s22p63s23p63d6(或[Ar]3d6) sp3、sp2 CO(或N2) 4∶3 KMgF3
【解析】
(1)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于N原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能数值由大到小的顺序为N>O>C。
(2)Fe是26号元素,其原子核外电子排布式为[Ar]3d64s2,Fe2+为Fe原子失去4s上2个电子,则Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6。
(3)乙酰基二茂铁中甲基碳原子采用sp3杂化,羰基碳原子采用sp2杂化。
(4)配合物K3Fe(CN)6的配体为CN-,C得到一个e-为N或N得到一个e-为O,所以CN-与N2或CO互为等电子体;(CN)2为直线型分子,具有对称性,其结构式为N≡C-C≡N,单键为σ键,CN中含有一个σ键,2个π键,因此(CN)2中π键和σ键的个数比为4∶3。
(5)根据晶胞结构可知,Mg2+、F-、K+分别位于顶点、棱心和体心处,根据均摊法可知,晶胞中含有的Mg2+、F-、K+个数分别是8×1/8=1个、12×1/4=3个、1个,所以该物质的化学式为KMgF3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)根据烯烃、炔烃的命名原则,回答下列问题:
①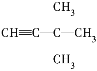 的名称是_____________________。
的名称是_____________________。
②![]() 的名称是_____________________。
的名称是_____________________。
③写出2甲基2戊烯的结构简式__________________。
④某烯烃的错误命名是2-甲基-4-乙基-2-戊烯,那么它的正确命名应是_____________________。
(2)有两种烃,甲为![]() ,乙为
,乙为![]() 。下列有关它们命名的说法正确的是____。
。下列有关它们命名的说法正确的是____。
A.甲、乙的主链碳原子数都是6个
B.甲、乙的主链碳原子数都是5个
C.甲的名称为2丙基1丁烯
D.乙的名称为3甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
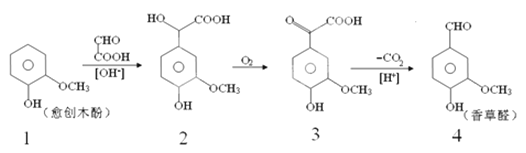
下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
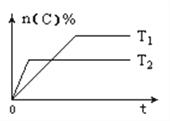

A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用如图装置进行实验,试回答下列问题:
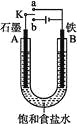
(1)若开始时开关K与a连接,则B极的电极反应为____________________________________。
(2)若开始时开关K与b连接,则B极的电极反应为______,总反应的离子方程式为________。有关上述实验,下列说法正确的是(填序号)___。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
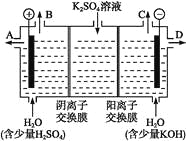
①该电解槽的阳极反应为______。
此时通过阴离子交换膜的离子数______(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_______________。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)写出下列元素的名称 X_______,Y________,Z__________
(2)X—H键和Y—H键属于极性共价键,其中极性较强的是________(X、Y用元素符号表示)键。X的第一电离能比Y的________(填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:________________。
(4)W的基态原子的价电子排布式为____________;
(5)Y元素的核外电子轨道表示式为___________。
(6)已知一种Y4分子结构如图所示:
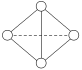
断裂1 mol Y—Y键吸收167 kJ的热量,生成1 mol Y≡Y放出942 kJ热量。则由1molY4气态分子变成2molY2气态分子_______(填写吸收或放出)_______kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究N2和H2直接合成NH3。在1.01×105Pa、250℃时,将1 molN2和1 molH2加入aL刚性容器中充分反应,测得NH3体积分数为0.04;其他条件不变,温度升高至450℃,测得NH3体积分数为0.025,则可判断合成氨反应为 ____填“吸热”或“放热”)反应。
(2)在1.01×105Pa、250℃时,将2 moIN2和2 molH2加入aL密闭容器中充分反应,H2平衡转化率可能为 ___(填标号)。
A =4% B <4% C 4%~7% D >11.5%
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
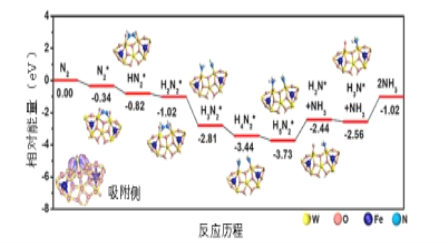
需要吸收能量最大的能垒(活化能)E=____ev,该步骤的化学方程式为____,若通入H2体积分数过大,可能造成 ___。
(4)T℃时,在恒温恒容的密闭条件下发生反应:![]() 反应过程中各物质浓度的变化曲线如图所示:
反应过程中各物质浓度的变化曲线如图所示:
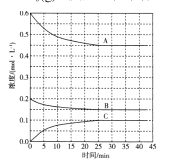
①表示N2浓度变化的曲线是 ____(填“A”、“B”或“C’,)。与(1)中的实验条件(1.01×105Pa、450℃)相比,改变的条件可能是_____。
②在0~25min内H2的平均反应速率为____。在该条件下反应的平衡常数为 ___mol-2.L2(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com