
【题目】铝是一种活泼的金属,在高温下能与Fe2O3反应生成Fe和Al2O3。该反应中___________(填化学式)是还原剂,_____________(填化学式)氧化剂。当2molFe2O3参加反应时,转移了 ____________ mol电子。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是

A. 电池总反应为:N2H4+2O2=2NO+2H2O
B. 电池内的O2-由电极乙移向电极甲
C. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4LO2参与反应
D. 电池正极方程式为:O2 + 4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 2NO2(g)![]() N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成 n mol N2O4 的同时生成 2n mol NO2
②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2
③用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态
④混合气体的颜色不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A. ①④⑤B. ②⑤C. ①③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( )
A. 13∶8∶29B. 22∶1∶14
C. 29∶8∶13D. 13∶16∶57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含碳化合物的结构与性质,对生产、科研等具有重要意义
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+计与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。
a.基态锂离子核外能量最高的电子所处能层符号为___________;
b.W中Li+与孤对电子之间的作用属于___________(选填字母标号)
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+计形成稳定结构。理由是___________。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶人冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________,H-O键键角___________(填“>”“<”或“=”)109°28′
ii.已知:冠醚Z与KMnO4可以发生右图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________。
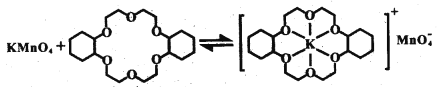
(2)甲烷是重要的清洁能源,其晶体结构如图所示,晶胞参数为anm。
①常温常压下不存在甲烷晶体。从微粒间相互作用的角度解释,其理由是___________;
②甲烷分子的配位数为___________;
③A分子中碳原子的坐标参数为(0,0,0),则B分子的碳原子的坐标参数为___________。
④甲烷晶体的密度为___________(g·cm-3)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.010 molL-1s-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取__mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用____mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将___(偏高、偏低、无影响)。
②配制时所需仪器除了量筒外,还需要的仪器有:_________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com