
| | Μν–‘ΧΩ (mol) | NO (mol) | A (mol) | B (mol) |
| ≥θ Φ | 2.030 | 0.100 | 0 | 0 |
| ΤΫΚβ | 2.000 | 0.040 | 0.030 | 0.030 |
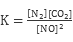 Θ®1Ζ÷Θ© ≤ΜΡήΘ§ΈόΖ®»ΖΕ®T1ΓΔT2ΒΡœύΕ‘ΗΏΒΆΓΘΘ®ΜρΡήΘ§Β±T1>T2 ±Θ§Ζ¥”Π «Έϋ»»Ζ¥”ΠΘ§Β±T1<T2 ±Θ§Ζ¥”Π «Ζ≈»»Ζ¥”ΠΘ®2Ζ÷Θ©
Θ®1Ζ÷Θ© ≤ΜΡήΘ§ΈόΖ®»ΖΕ®T1ΓΔT2ΒΡœύΕ‘ΗΏΒΆΓΘΘ®ΜρΡήΘ§Β±T1>T2 ±Θ§Ζ¥”Π «Έϋ»»Ζ¥”ΠΘ§Β±T1<T2 ±Θ§Ζ¥”Π «Ζ≈»»Ζ¥”ΠΘ®2Ζ÷Θ©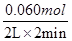 =0.015mol/(LΓΛmin)Θ§Ζ¥”ΠΒΡΥΌ¬ ΥφΉ≈≈®Ε»ΒΡΦθ–ΓΕχΦθ–ΓΘ§Ι ΩΣ ΦΩλΘ§ ±Φδ–Γ”Ύ1minΘΜ
=0.015mol/(LΓΛmin)Θ§Ζ¥”ΠΒΡΥΌ¬ ΥφΉ≈≈®Ε»ΒΡΦθ–ΓΕχΦθ–ΓΘ§Ι ΩΣ ΦΩλΘ§ ±Φδ–Γ”Ύ1minΘΜ

 –Γ―ßΕαΙΎABΨμœΒΝ–¥πΑΗ
–Γ―ßΕαΙΎABΨμœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΦΤΥψΧβ
 CH3OH(g)ΘΪH2O(g) ΠΛH =Θ≠49.0 kJΓΛmolΘ≠1
CH3OH(g)ΘΪH2O(g) ΠΛH =Θ≠49.0 kJΓΛmolΘ≠1| AΘ°n(CO2)ΓΟn(H2)ΓΟn(CH3OH)ΓΟn(H2O)ΘΫ1ΓΟ3ΓΟ1ΓΟ1 |
| BΘ°»ίΤςΡΎ―Ι«Ω±Θ≥÷≤Μ±δ |
| CΘ°H2ΒΡœϊΚΡΥΌ¬ ”κCH3OHΒΡœϊΚΡΥΌ¬ ÷°±»ΈΣ3ΓΟ1 |
| DΘ°»ίΤςΡΎΒΡΟήΕ»±Θ≥÷≤Μ±δ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΧνΩ’Χβ
 CH3CH2OH(g)+3H2O(g) Θ≠QΘ®QΘΨ0Θ©
CH3CH2OH(g)+3H2O(g) Θ≠QΘ®QΘΨ0Θ©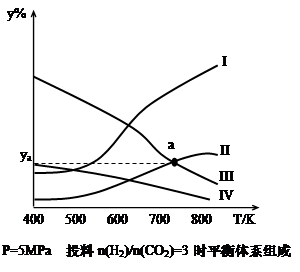
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΧνΩ’Χβ
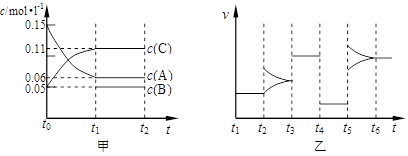
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
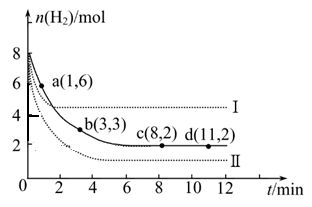
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
 C(g)+2D(g) ΠΛH<0Θ§ΤΫΚβ ±CΒΡΈο÷ ΒΡΝΩ”κΦ”»κBΒΡΈο÷ ΒΡΝΩΒΡ±δΜ·ΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
C(g)+2D(g) ΠΛH<0Θ§ΤΫΚβ ±CΒΡΈο÷ ΒΡΝΩ”κΦ”»κBΒΡΈο÷ ΒΡΝΩΒΡ±δΜ·ΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
| AΘ°‘ωΦ”AΒΡΈο÷ ΒΡΝΩΘ§’ΐΖ¥”ΠΥΌ¬ Φ”Ωλ |
| BΘ°ΤΫΚβ ±Θ§ΤδΥϊΧθΦΰ≤Μ±δΘ§Β±Έ¬Ε»…ΐΗΏ ±Θ§Π»±δ¥σ |
| CΘ°ΆΦ÷–«ζœΏΒΡ–±¬ ±μ ΨΖ¥”ΠΒΡΜ·―ßΤΫΚβ≥Θ ΐ |
| DΘ°ΤΫΚβ ±Θ§ΤδΥϊΧθΦΰ≤Μ±δΘ§‘ΌΆ®»ΥBΘ§‘ρΖ¥”ΠΜλΚœΈοΒΡΈ¬Ε»…ΐΗΏ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
 qZ(g)+pW(s)ΒΡΠΛHΘΦ0Θ§m+n>qΘ§‘ΎΚψ»ίΟή±’»ίΤς÷–Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§œ¬Ν–ΥΒΖ®“ΜΕ®’ΐ»ΖΒΡ «
qZ(g)+pW(s)ΒΡΠΛHΘΦ0Θ§m+n>qΘ§‘ΎΚψ»ίΟή±’»ίΤς÷–Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§œ¬Ν–ΥΒΖ®“ΜΕ®’ΐ»ΖΒΡ «| AΘ°Ά®»κΚΛΤχ ΙΟή±’»ίΤς÷–―Ι«Ω‘ω¥σΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ· |
| BΘ°‘ωΦ”XΒΡΈο÷ ΒΡΝΩΘ§ΜλΚœΤχΧεΒΡΟήΕ»Φθ–Γ |
| CΘ°ΫΒΒΆΈ¬Ε»Θ§ΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ‘ω¥σ |
| DΘ°XΒΡ’ΐΖ¥”ΠΥΌ¬ «YΒΡΡφΖ¥”ΠΥΌ¬ ΒΡm/n±Ε |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΧνΩ’Χβ
 2NH3(g)+92.4 kJ/mol673KΘ§30MPaœ¬Θ§…œ ωΚœ≥…Α±Ζ¥”Π÷–n(NH3)ΚΆn(H2)Υφ ±Φδ±δΜ·ΒΡΙΊœΒ»γ”“ΆΦΥυ ΨΓΘ
2NH3(g)+92.4 kJ/mol673KΘ§30MPaœ¬Θ§…œ ωΚœ≥…Α±Ζ¥”Π÷–n(NH3)ΚΆn(H2)Υφ ±Φδ±δΜ·ΒΡΙΊœΒ»γ”“ΆΦΥυ ΨΓΘ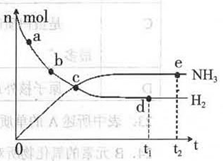
 2NH3(g)ΒΡΤΫΚβ≥Θ ΐ÷ΒΈΣΘΚ___ΓΘ
2NH3(g)ΒΡΤΫΚβ≥Θ ΐ÷ΒΈΣΘΚ___ΓΘ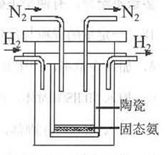
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
 N2(g)ΘΪCO2(g)ΘΪ2H2O(g) ΠΛHΘΫa kJ/mol
N2(g)ΘΪCO2(g)ΘΪ2H2O(g) ΠΛHΘΫa kJ/mol| Έ¬Ε» | ±Φδ/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | Γ≠Γ≠ | 0.15 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
 CH3OCH3(g) + H2O(g) ΒΡΤΫΚβ≥Θ ΐΈΣ400ΓΘ¥ΥΈ¬Ε»œ¬Θ§‘Ύ»ίΜΐ“ΜΕ®ΒΡΟή±’»ίΤς÷–Φ”»κCH3OHΘ§Ζ¥”ΠΒΫΡ≥ ±ΩΧ≤βΒΟΗςΉιΖ÷ΒΡ≈®Ε»ΈΣ±μ÷–œύ”ΠΒΡ ΐΨίΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
CH3OCH3(g) + H2O(g) ΒΡΤΫΚβ≥Θ ΐΈΣ400ΓΘ¥ΥΈ¬Ε»œ¬Θ§‘Ύ»ίΜΐ“ΜΕ®ΒΡΟή±’»ίΤς÷–Φ”»κCH3OHΘ§Ζ¥”ΠΒΫΡ≥ ±ΩΧ≤βΒΟΗςΉιΖ÷ΒΡ≈®Ε»ΈΣ±μ÷–œύ”ΠΒΡ ΐΨίΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «| Έο÷ | CH3OH | CH3OCH3 | H2O |
| ≈®Ε»/Θ®molΓΛL-1Θ© | 0.44 | 0.6 | 0.6 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com