
| A、2.3g | B、3.1g |
| C、4.6g | D、5.3g |
| 46g×0.10g |
| 2g |
| 92g×3.1g |
| 124g |


科目:高中化学 来源: 题型:
| 物 质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
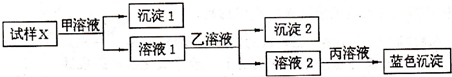
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.03mol |
| B、0.02mol |
| C、大于0.02mol |
| D、小于0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
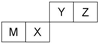
| A、X 的最简单气态氢化物的热稳定性比Z的小 |
| B、Z位于元索周期表中第2周期、第ⅥA族 |
| C、原子半径Z<M |
| D、Y的最高价氧化物对应水化物的酸性比X 的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com