
| 方案编号 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
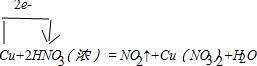
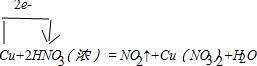
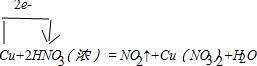
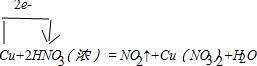 ;
;

科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4•5H2O是一种重要的化工原料。实验室以Cu为原料制取CuSO4·5H2O
![]() 有如下方法:
有如下方法:
方法一:
 (1)该方法中金属铜应在 (填仪器名称)中灼烧。
(1)该方法中金属铜应在 (填仪器名称)中灼烧。
方法二:
(2)该方法中少量![]() 起催化作用,其催化机理为(用离子方程式表示)
起催化作用,其催化机理为(用离子方程式表示)
![]() , 。调节溶液PH3~4,可使
, 。调节溶液PH3~4,可使![]() 完全转化为
完全转化为![]() 沉淀,调节时加入的试剂为 。
沉淀,调节时加入的试剂为 。
 方法三:
方法三:
(3)①该方法中首先要将Cu与稀硫酸和稀硝酸混合。为了只得到
 CuSO4溶液,需向100mLl.0moI• L-1稀硝酸中加入 mL 1.0mol·L-1稀硫酸与之混合。
CuSO4溶液,需向100mLl.0moI• L-1稀硝酸中加入 mL 1.0mol·L-1稀硫酸与之混合。
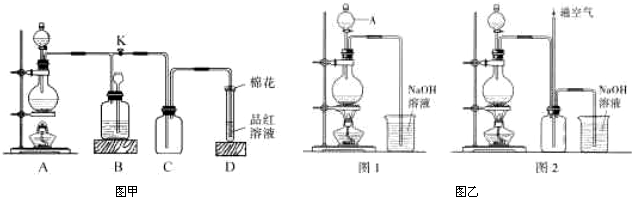
②Cu与稀硫酸和稀硝酸的反应装置如右图所示:
实验室中对圆底烧瓶加热的最佳方式是 ;
装置中圆底烧瓶上方长导管的作用是 。
③下列可做为右图中尾气收集或吸收装置的是 (填字母)。
(提示:![]()

(4)上述方法中,方法一耗能大,方法二步骤多,方法三生成有毒气体。请综合考虑有关
设 计 因 素 , 设 计 一 个 实 验 室 制 备 CuSO4·5H2O的 方 案 流 程
图 。
供选择的试剂:Cu、![]() 、
、![]() 、
、![]() 、浓硫酸、稀盐酸、稀硫酸等
、浓硫酸、稀盐酸、稀硫酸等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com