
| m |
| M |
| 5.6g |
| 56g/mol |
| 0.1mol×2 |
| 1 |
| 0.1mol×1 |
| 1 |


科目:高中化学 来源: 题型:
| A、1:1 | B、4:1 |
| C、5:1 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性锌锰电池是二次电池 |
| B、MnO2发生了还原反应 |
| C、反应消耗 0.65gZn,有0.01 mol电子发生转移 |
| D、电池正极的反应为:Zn+2 OH--2e-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾常作为消毒剂 |
| B、发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 |
| C、高纯度的硅单质广泛用于制作光导纤维 |
| D、氧化铝可用来制造耐火砖和坩埚等 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
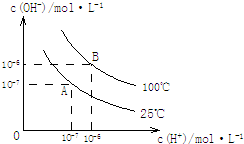 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com