
【题目】四川盛产五倍子。以五倍子为原料可制得化合物A。A的结构简式如下图所示。请解答下列各题:

(1)A的分子式是__________________。
(2)有机化合物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式_________________。
(3)请写出A与过量NaOH溶液反应的化学方程式_________________。
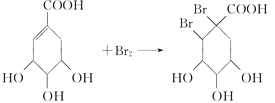
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看成是B与氢气按物质的量之比1∶2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式: _________________。
【答案】C14H10O9 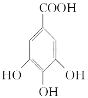
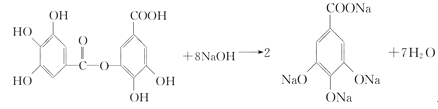
【解析】
(1)根据A的结构简式判断A的分子式;
(2)分子中含有酯基,可水解,根据水解产物分析解答;
(3)分子中的酚羟基和酯基都可与NaOH反应;
(4)C可以看成是B与氢气按物质的量之比1:2发生加成反应得到的产物,C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色,说明C中含有碳碳双键,据此分析解答。
(1)根据有机物的结构简式可知A的式为C14H10O9,故答案为:C14H10O9;
(2)A分子中含有酯基,可水解,水解生成一种物质,为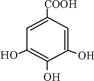 ,因此B为
,因此B为 ,故答案为:
,故答案为: ;
;
(3)分子中的酚羟基和酯基都可与NaOH反应,该反应的化学方程式为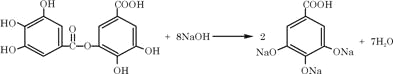 ,故答案为:
,故答案为: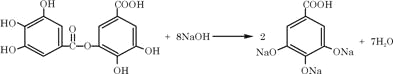 ;
;
(4)C可以看成是B与氢气按物质的量之比1:2发生加成反应得到的产物.C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色,说明含有碳碳双键,C应为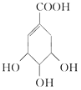 ,C与溴发生加成反应的方程式为
,C与溴发生加成反应的方程式为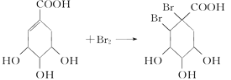 ,故答案为:
,故答案为: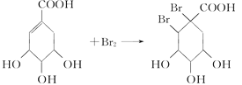 。
。


科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,它与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:

(1)元素Ga位于Al的下一周期,写出镓(Ga)的原子结构示意图为____________CO2的电子式为_____________________
(2)下列有关Al、Ga的说法不正确的是______
A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
(3)图中涉及到的Al、Na、O三种元素简单离子半径由大到小的顺序_____________
(4)步骤二中不能通入过量的CO2,理由_________________(用离子方程式表示)
(5)工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含Zn、Fe、Cu杂质,以NaOH水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:Zn2+<Ga3+<Fe2+)
①下列有关电解精炼说法正确的是_______
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式__________________________________
(6)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。氮化镓(GaN)的一种制备方法是采用GaCl3与NH3在一定条件下反应,写出该反应的化学方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:①Na2CO3+SiO2![]() Na2SiO3+CO2↑;②CaCO3+SiO2
Na2SiO3+CO2↑;②CaCO3+SiO2![]() CaSiO3+CO2↑。
CaSiO3+CO2↑。
(1)反应①中,被破坏的微粒间的作用力有__________(选填编号)。
a. 范德华力 b. 离子键 c. 共价键
(2)上述两个反应的反应物和生成物中,涉及到的不同类型的晶体有____种(填数字),其中熔沸点最低的化合物的电子式为___;该化合物熔沸点低于CS2的原因是____。
(3)纯碱中的金属阳离子的半径比铝离子半径______(填“大”或“小”);石灰石中的金属阳离子的电子所占据的电子层中,能量最高的是___层(填“电子层符号”)。
(4)已知10 g碳酸钙完全分解,共吸收17.56 KJ的热量,写出该反应的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.4g氨气中所含NH3分子数为 _____,所含氢原子个数为 ______,标准状况下的体积为_____L,所含电子的物质的量为 _____ mol,将其溶于水配成200mL溶液,其物质的量浓度为___ mol/L。
(2)32克某气体含有6.02×1023个气体分子,则该气体的摩尔质量为 _____。
(3)标准状况下有①6.72LCH4 ②3.01×1023个HCl分子③13.6g H2S气体④0.2molNH3,体积最大的是___,密度最小的是___,质量最小的是__(填序号)。
(4)用等体积的0.1 mol·L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42- 都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的核工业原料。下列有关
是重要的核工业原料。下列有关![]() 、
、![]() 说法正确的是
说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 互为同素异形体
互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂。可由硫和氯气在100~110 ℃直接化合而成。实验室用以下装置制备S2Cl2并对尾气进行回收利用。已知S2Cl2的熔点:-77 ℃,沸点:137 ℃,S2Cl2遇水剧烈反应。

(1)S2Cl2遇水会生成黄色单质、一种能使品红溶液褪色的气体化合物及酸雾,写出该反应的化学方程式__________________________________。
(2)B中所装试剂名称为__________________________。
(3)A、B装置中的空气可以通过控制K2、K3来去除,具体方法为_________。
(4)装置E的作用是____________________________________________,写出E中发生的氧化还原反应的化学方程式_________________________。
(5)实验时,D装置开始需要油浴加热一段时间,之后停止加热,仅需通入氯气即可。生成二氯化二硫的反应为________ (填“放热”或“吸热”)反应。
(6)该装置由于存在系统缺陷,使制得的二氯化二硫可能不纯,现需对该装置进行改进,则改进的方法为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制500mL 0.2mol/L的Na2CO3溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取___________g Na2CO3。
(2)除用到天平外,还一定会用到的玻璃仪器有烧杯、玻璃棒、_____________、_______________
(3)下列操作使所配溶液浓度偏大的是_____________(填写序号)。
A.称取28.6g Na2CO3·10H2O进行配制
B.称量时用了生锈的砝码
C.往容量瓶转移溶液时,有少量液体溅出
D.Na2CO3中含有不溶性杂质
E.未洗涤溶解Na2CO3的烧杯
F.定容时俯视刻度线
G.容量瓶未干燥即用来配制溶液
H.砝码与药品位置放反了且用了游码
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是

A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com