
【题目】下列有关化工生产的叙述错误的是( )
①电解熔融的氯化钠制取金属钠 ②将钠加入氯化镁饱和溶液中制取镁 ③用电解法冶炼铝时,原料是氯化铝 ④炼铁时高炉中所发生的反应都是放热反应,故无需加热
A. ②③ B. ①③ C. ①②③ D. ②③④
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
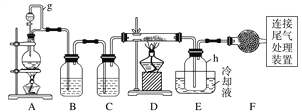
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:____________________________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h瓶需要冷却的理由是________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO![]() +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由:
____________________________________________________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
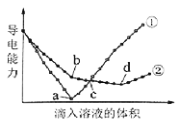
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制一种仅含四种离子(不包括水电离的离子)的无色混合溶液,且要求混合溶液中四种离子的浓度均相等,下列选项能达到要求的是
A.Cu2+、NH4+、SO42-、NO3- B.Ca2+、Al3+、NO3-、Cl-
C.Na+、Mg2+、SO42-、I- D.H+、HCO3-、K+ 、F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→ O2 ,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4>O2
D.如反应转移了0.3mol电子,则产生的气体在标准状况下体积为3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:

试回答下列问题:
(1)试剂X为__________;
(2)操作Ⅰ、操作Ⅱ均为_____________(填操作名称),在实验室进行该操作时需要的玻璃仪器有__________________________________;
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______________________________,请举一例该反应的用途________________________;
(4)反应Ⅱ的离子方程式为____________________________________________________;
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com