
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
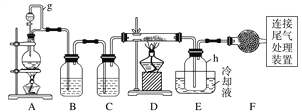
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:____________________________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h瓶需要冷却的理由是________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO![]() +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由:
____________________________________________________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 平衡气压 浓H2SO4 SiCl4沸点较低,用冷却液可得到液态SiCl4 Al、Cl、P 否 MnO
Mn2++Cl2↑+2H2O 平衡气压 浓H2SO4 SiCl4沸点较低,用冷却液可得到液态SiCl4 Al、Cl、P 否 MnO![]() 有颜色,故不需其他指示剂 4.48%
有颜色,故不需其他指示剂 4.48%
【解析】制备四氯化硅的原料为Cl 2 和Si。A装置为Cl2 的制备装置,B、C装置为除杂装置。先用B除去HCl,再用C(浓H2SO4 )除去H 2 O蒸气。Cl 2 通入粗硅中反应,用冷水将产生SiCl 4 冷凝即可。(1)制取氯气用浓盐酸和MnO 2 在加热条件下反应。(2)g管是将分液漏斗与烧瓶相连,则它们中的压强是相待的,这样便于盐酸能顺利滴下。SiCl 4 的沸点很低,只有57.7℃,而反应的温度达几百度,故需要冷凝收集。(3)从物质的物理性质表可发现,AlCl 3 ,FeCl 3 和PCl 5 均易升华,故还应还有Al、P、Cl元素。(4)由于高锰酸钾本身是紫红色的,与Fe 2+ 反应时,可以褪色,故而可以作为指示剂。根据方程式可以找出关系,5Fe2+ ~MnO4- , n (Fe)= 10 -2 ×20×10 -3 ×5×![]() =4×10 -3 mol。W (Fe)= 4×10 -3 ×
=4×10 -3 mol。W (Fe)= 4×10 -3 ×![]() ×100% =4.48%。
×100% =4.48%。


科目:高中化学 来源: 题型:
【题目】一定条件下,将SO2和O2充入体积为2L的密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:

回答下列问题:
(1)用 SO2表示0~15min的平均反应速率为__________。降低温度,SO2的转化率_________,化学反应速度_____________。(填“增大”“减小”或“不变”)。
(2)反应处于平衡状态的时间是 ________。则该反应正反应为_________(填“吸热”或“放热”)反应。
(3)反应进行至20min时,曲线发生变化的原因是 _____________(用文字表达);10~15min的曲线变化的原因可能是_____(填写编号)。
a.加了催化剂 b.升高温度 c.降低温度 d.增加SO3的物质的量
(4)在相同的温度时,在该2L的密闭容器中充入的是0.1mol的SO3,0.05mol的O2,0.05的SO2,平衡时若想SO2的体积分数与上述平衡时相同,则应再加入(填SO2、O2、SO3 ) __________,为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是
A. 与H2化合的能力:At2>I2 B. 砹在常温下为白色固体
C. 砹原子的最外层有7个电子 D. 砹易溶于水,难溶于四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】amol N2与bmol H2混合,要一定条件下反应达到平衡,生成了cmolNH3,则NH3在平衡体系中质量分数为
A. 17c/(28a+2b-17c)×100% B. 17c/(28a+2b)×100%
C. c/(a+b+c)×100% D. 34c/(28a+2b)×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )
A.一定有甲烷B.一定有乙烯C.一定没有甲烷D.一定没有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是 ( )

A.a曲线表示的离子方程式为:AlO2-+H++H2O ==Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9 g
D.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化工生产的叙述错误的是( )
①电解熔融的氯化钠制取金属钠 ②将钠加入氯化镁饱和溶液中制取镁 ③用电解法冶炼铝时,原料是氯化铝 ④炼铁时高炉中所发生的反应都是放热反应,故无需加热
A. ②③ B. ①③ C. ①②③ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com