
【题目】下列说法不正确的是( )
A.漂白粉可用于环境消毒
B.钠单质可应用于电光源领域
C.用焦炭还原二氧化硅可得高纯硅
D.明矾可用于净水
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A. FeCl3=Fe2++3Cl﹣
B. NaOH=Na++OH﹣
C. H2SO4=H2++SO42﹣
D. NaHCO3=Na++H++CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质按F2、Cl2、Br2、I2顺序,下列性质递变规律正确的是
A. 颜色由浅变深 B. 氧化性逐渐增强
C. 氢化物的稳定性逐渐增强 D. 密度依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关漂白粉和漂白液的说法正确的是
A. 漂白粉是纯净物,漂白液是混合物 B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉 D. 漂白液的有效成分是Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应离子方程式为:2Fe3+ +Fe = 3Fe2+,能实现该反应的原电池是
A. 电极材料为铁和锌,电解质溶液为Fe2(SO4)3溶液
B. 电极材料都是铁,电解质溶液为Fe(NO3)2溶液
C. 电极材料为铁和石墨,电解质溶液为FeCl3溶液
D. 电极材料为铁和石墨,电解质溶液为FeCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)将切开的小块钠投入水中,现象是_____________________;发生反应的化学方程式为________________________________;该反应中的氧化剂是___________;还原剂是__________;在反应后的溶液中加入FeCl3溶液,现象是____________;反应的方程式为________________________________________________。
(2)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的反应离子方程式为_______________。
(3)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等量的镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A.2 mol·L-1H2SO4溶液
B.3 mol·L-1CuSO4溶液
C.6 mol·L-1KOH溶液
D.3 mol·L-1Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
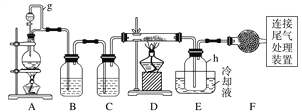
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:____________________________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h瓶需要冷却的理由是________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO![]() +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由:
____________________________________________________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com