
【题目】短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应m+n![]() p↑+q;M的最高价氧化物对应的水化物为最强酸。则下列说法不正确是
p↑+q;M的最高价氧化物对应的水化物为最强酸。则下列说法不正确是
A. 简单离子半径X<Z<Y<M
B. 由X、Y、Z三种元素组成的化合物可以是离子化合物
C. X、Y、Z三种元素组成的化合物的水溶液一定呈酸性
D. MZ2可用于自来水的杀菌消毒
【答案】C
【解析】
短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应m+n![]() p↑+q,符合此反应的应为NH4++OH-
p↑+q,符合此反应的应为NH4++OH-![]() NH3↑+H2O,又M为短周期元素,M的最高价氧化物对应的水化物为最强酸,所以X为H,Y为N,Z为O,M为Cl,据此答题。
NH3↑+H2O,又M为短周期元素,M的最高价氧化物对应的水化物为最强酸,所以X为H,Y为N,Z为O,M为Cl,据此答题。
A.由上述分析可知,简单离子半径X<Z<Y<M,故A正确;
B.由X、Y、Z三种元素组成的化合物可能是HNO3、NH3·H2O、NH4NO3,其中NH4NO3为离子化合物,故B正确;
C.X、Y、Z三种元素组成的化合物的水溶液可能呈酸性,如HNO3、NH4NO3,也可能呈碱性,如NH3·H2O,故C错误;
D.由上述分析可知,MZ2为ClO2,具有强氧化性,可用于自来水的杀菌消毒,故D正确。
故选C。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 只含有非金属元素的化合物可能是离子化合物
B. 第ⅠA族元素都比第ⅡA族元素金属性强
C. 只含有共价键的物质一定是共价化合物
D. 同主族元素原子半径越小越容易失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的分子式为C8H10
B. “PX”的二氯代物共有6种(不考虑立体异构)
C. “PX”分子中,最多有14个原子共面
D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
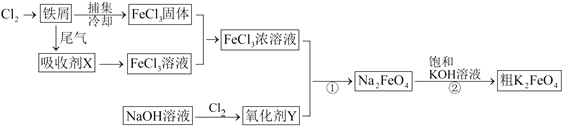
请回答下列问题:
(1)吸收剂X的化学式为__________,氧化剂Y的化学式为________。
(2)碱性条件下反应①的离子方程式为_____________。
(3)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___(填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
(Ⅱ)日常生活和生产与化学紧密相连。
(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 ______。
A.能全部透过半透膜B.有丁达尔效应
C.所得液体不稳定,会分层D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题:
①可以利用 ______ 鉴别水溶液和胶体。
②60℃左右时,在淀粉胶体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应,从半透膜里析出的物质是 ______ ,该操作的名称是 ______。
(3)生活和生产中常用到胶体的性质,请看下述几例:
①手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是 ______。
②水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少对空气的污染,这种作用运用了 ______ 原理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X和Y的原子序数都小于18,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
A. n+11 B. n-5 C. n+3 D. n-6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g)△H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后
2C3(g)△H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后![]() 的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
(1) a__________(填“>”、“=”或“ <”) b。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中T1__________(填“ >”、“ < ”或“ =”) T2。
|
|
|
|
|
|
|
|
若在原来的容器中,只加入2molC3,500℃时充分反应达到平衡后,吸收热量ckJ,则C3的浓度__________(填“>”、“=” 或“ <”) xmol·L-1,a、b、c之间满足何种关系?__________(用代数式表示)。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是__________(填字母)。
A.4molA2和2molB2 B.4molA2、2molB2和2molC3
C.4molA2和4molB2 D.6molA2和4molB2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________(填字母)。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达到平衡后,放出热量dkJ,则d__________(填“>”、“=” 或“ <”) b,理由是__________。
(6)在一定温度下,在一个容积不变的容器中通入2molA2和1molB2及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为4molA2和2molB2,则平衡时A2的转化率__________(填span>“不变”、“变大”、“变小”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有下列四种规格的量筒,要准确量取11.0mL的稀盐酸,应选用的量筒是( )
A. 10mL量筒B. 20mL量筒C. 50mL量筒D. 100mL量筒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学为研究有机物A和B的结构和性质,分别取7.4gA和6.0gB置于密闭容器中完全燃烧,测得有关数据如下:
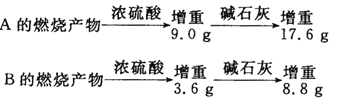
由以上信息可求出:
(1)A物质的分子式为______。已知A和金属Na不反应,则其可能的结构有______种。
(2)B物质的最简式为_______。所有符合该最简式的物质中,相对分子质量最小的物质与酸性高锰酸钾反应的离子方程式为______ 。
(3)相同条件下,相同质量B物质的蒸气所占体积为H2体积的1/30,且B可以发生银镜反应,但不能发生水解反应。写出其结构简式______ 。
(4)若B分子中有3个碳原子,能与NaHCO3反应产生CO2气体,且等效氢的个数比为3:1:1:1,则该物质的系统命名法名称为______ 。
(5)若符合B物质最简式的某物质是生命体中重要的能量物质,在一定条件下可以转化为乙醇,写出该转化反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
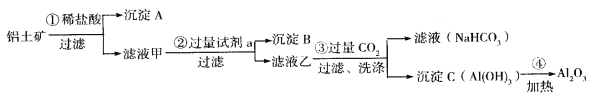
①沉淀A成分是____________;步骤②中的试剂a是_________;(以上均填化学式)。
②简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂A可选用_________________(填编号,下同)。
A KMnO4 B HNO3 C Cl2 D 浓盐酸
②试剂B可选用____________________。
A NaOH B CuO C FeO D HCl
③试剂B的作用是_______________________________。
A 使Cu2+完全沉淀 B 使Fe3+完全沉淀 C 提高溶液的pH D 除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com