
 W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.
W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.分析 W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素,W的基态原子中占据哑铃形原子轨道的电子数为3,则W为N元素;
X2+与W3-具有相同的电子层结构,这两种离子核外有10个电子,则X为Mg元素;
Z元素位于元素周期表的第6列,则Z为Cr元素;
Y原子序数小于24,W与X的最外层电子数之和等于Y的最外层电子数,则Y为Cl元素;
(1)Z为Cr元素,Z的基态原子的价电子为3d、4s电子,根据构造原理书写基态Cr原子价电子排布式;
(2)NCl3分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的立体构型;
(3)W的简单氢化物为NH3,氨气分子中,原子间形成σ键时,发生重叠的原子轨道分别为sp3杂化轨道和s轨道;
(4)同一种元素的含氧酸中,含有非羟基氧原子个数越多,其酸性越强;
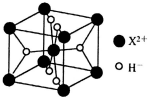
(5)离子型氢化物MgH2的晶胞中,其中阴离子的配位数为3;
(6)强酸条件下,Cr2O72-能与乙醇反应生成Cr3+离子,乙醇被氧化生成乙酸,根据反应物和生成物书写该反应的离子方程式.
解答 解:W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素,W的基态原子中占据哑铃形原子轨道的电子数为3,则W为N元素;
X2+与W3-具有相同的电子层结构,这两种离子核外有10个电子,则X为Mg元素;
Z元素位于元素周期表的第6列,则Z为Cr元素;
Y原子序数小于24,W与X的最外层电子数之和等于Y的最外层电子数,则Y为Cl元素;
(1)Z为Cr元素,Z的基态原子的价电子为3d、4s电子,Cr原子3d、4s能级上电子数分别是5、1,根据构造原理书写基态Cr原子价电子排布式为3d54s1,
故答案为:3d54s1;
(2)NCl3分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形,故答案为:三角锥形;
(3)W的简单氢化物为NH3,氨气分子中,原子间形成σ键时,发生重叠的原子轨道分别为sp3杂化轨道和s轨道,故答案为:sp3杂化轨道和s轨道;
(4)同一种元素的含氧酸中,含有非羟基氧原子个数越多,其酸性越强,HYO2 中非羟基O原子个数是1、HYO中没有非羟基氧原子,所以酸性HYO2>HYO,故答案为:>;
(5)离子型氢化物MgH2的晶胞中,每个氢离子连接晶胞中体心上的镁离子和一个顶点上的镁离子,共3个镁离子,所以阴离子的配位数为3,故答案为:3;
(6)强酸条件下,Cr2O72-能与乙醇反应生成Cr3+离子,乙醇被氧化生成乙酸,根据反应物和生成物书写该反应的离子方程式为2Cr2O72-+3C2H5OH+16H+═4Cr3++3CH3COOH+11H2O,
故答案为:2Cr2O72-+3C2H5OH+16H+═4Cr3++3CH3COOH+11H2O.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、氧化还原反应、原子杂化、微粒空间构型判断等知识点,明确物质结构、基本原理、原子结构是解本题关键,侧重考查学生分析判断、计算及空间想象能力,易错点是判断阴离子配位数.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NaHCO3溶液中加入过量的 Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 氯化铝溶液中加入过量氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )| A. | 常温下,Ka 1:Ka 2=1000 | |
| B. | 将相同物质的量 KHC2O4 和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液 | |
| C. | pH=1.2 溶液中:c(K +)+c(H + )=c(OH-)+c(H2C2O4) | |
| D. | 向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)═c(HCO3-)+c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-) | |
| C. | 向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13 | |
| D. | 将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,加聚反应.
,加聚反应. +3HNO3(浓)$→_{△}^{浓硫酸}$
+3HNO3(浓)$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com