
【题目】下列器具不属于陶瓷制品的是()
A. 表面皿 B. 唐三彩 C. 秦兵马俑 D. 蒸发皿
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种无色的可燃液体。请回答下列问题:
(1)联氨是火箭的重要燃料。已知:
(a) N2H4(l)的燃烧热ΔH1 = –624.0 kJmol–1
(b) ![]() ΔH2 = –66.4 kJmol–1
ΔH2 = –66.4 kJmol–1
(c) ![]() ΔH3 = –28.6 kJmol–1
ΔH3 = –28.6 kJmol–1
写出N2H4(l)在N2O4(g)中燃烧生成氮气和液态水的热化学方程式________________。
(2)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3xH2O)变成磁性氧化铁,从而可减缓锅炉锈蚀。反应过程中每生成0.1 mol磁性氧化铁,转移的电子数为_________________。
(3)联氨-空气燃料电池的电解质为KOH溶液。写出该电池放电时负极的反应式________。
(4)联氨的制备方法有多种,尿素法是其中之一。在KMnO4的催化作用下,尿素CO(NH2)2和NaClO、NaOH溶液反应生成联氨、水和两种钠盐,写出该反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空:
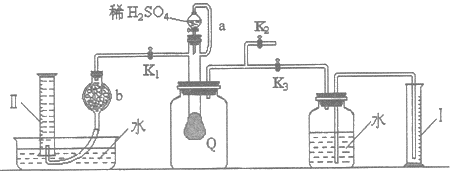
(1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:________。
(2)导管a的作用是________。
(3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭________(填K1、K2、K3,下同),打开________。
(4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________。
(5)b中装的固体试剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.06molFeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+ , Cr2O72﹣还原为Cr3+ . 则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
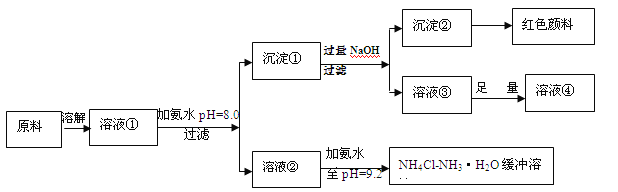
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 mL 0.5 mol·L-1的稀硫酸的实验操作,请按要求填空:
(1) 计算所需浓硫酸的体积为________mL(保留一位小数);
(2) 如果实验室有10 mL、20 mL、50 mL的量筒,应选___________规格的量筒最好,如果量取浓硫酸时仰视读数,所配溶液浓度将(填“偏高”、“偏低”或“无影响”)___________;
(3) 将量取的浓硫酸沿烧杯内壁慢慢注入盛有约100 mL水的__里,并不断搅拌,搅拌的目的是_____;
(4) 将冷却至室温的上述溶液沿________注入________中,并用50 mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡;
(5) 加水至距刻度线1~2 cm处,改用________加水至刻度线,使溶液的________________恰好跟容量瓶刻度线相平,把容量瓶塞好,反复颠倒振荡,摇匀溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子合物J的合成路线如下:
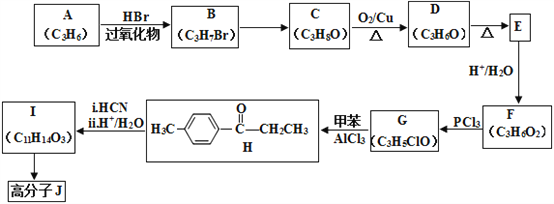
已知:i. 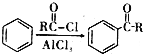
ii. 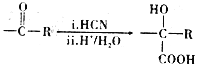
(1)写出A的结构简式:________________________。
(2)由B→C的反应条件为:________________,反应类型为:_________________。
(3)H中官能团名称:________________________。
(4)D 与新制的银氨溶液反应生成E的化学方程式:__________________________________________。
(5)由I合成高分子化合物J的化学方程式为____________________________________。
(6)有机物L(C9H10O3)符合下列条件的同分异构体有___________种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基,且只有一个烷基
(7)结合上述流程中的信息,设计由![]() 制备
制备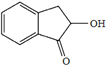 的合成路线。合成路线流程图示例:
的合成路线。合成路线流程图示例:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5,______________________。
CH3COOC2H5,______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学概念有关的说法正确的是( )
A.化合反应均为氧化还原反应
B.金属氧化物均为碱性氧化物
C.烧碱、纯碱、熟石灰都是碱
D.BaSO4、NaOH、HNO3都是强电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com