
【题目】以乙炔或苯为原料可以合成有机酸H2MA,并进一步合成高分子化合物PMLA。
(一)用乙炔等有机物合成烃C。

已知:①乙炔与甲醛1:2反应生成A。
②
(1)A分子中的官能团名称是__________、__________。
(2)B转化为C的化学方程式是_________________________,其反应类型是__________。
(二)用烃C或苯合成PMLA的路线如下。

已知:![]()
(3)1mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO244.8L,H有顺反异构,其反式结构简式是__________。
(4)E的核磁共振氢谱有3组峰,则E的结构简式是__________。
(5)G与NaOH溶液在加热条件下反应的化学方程式是__________。
(6)聚酯PLMA有多种结构,其中一种的主链中有-CH2-结构,写出由H2MA制该种PMLA的化学方程式______________________________________。
【答案】 羟基、 碳碳三键 ![]() 消去反应
消去反应 ![]() HOCH2CH=CHCH2OH
HOCH2CH=CHCH2OH ![]()
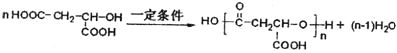
【解析】(1)由所给已知得A中官能团的名称是羟基、碳碳三键;(3)B应为1,4-丁二醇,在浓硫酸催化下发生消去反应,生成1,3-丁二烯和水,化学方程式为:![]() ;(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8L,说明H分子中有2个羧基,H有顺反异构,所以H中还有碳碳双键,其反式结构简式是
;(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8L,说明H分子中有2个羧基,H有顺反异构,所以H中还有碳碳双键,其反式结构简式是![]() ;
;
(5)H2MA的结构简式可推出,由G倒推得E的结构简式为HOCH2CH=CHCH2OH;
(6)从G到H2MA发生水解、酸化,所以G与氢氧化钠溶液的反应化学方程式为![]() ;
;
(7)由H2MA制PMLA发生脱水缩合反应,化学方程式为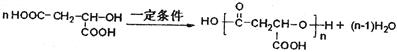 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硒元素(selenium)是第四周期、VIA族元素,单质有红硒、黑硒和灰硒,其中灰硒有良好的导热导电性,且有显著的光电效应,可应用于光电半导体材料。请回答下列问题:
(1)Se原子的核外电子排布式为[Ar]___________。
(2)As和Se是同一周期的元素,As的第一电离能比Se大,原因是____________。
(3)![]() 中Se―O的键角比SeO3的键角_______(填“大”或“小”),原因是____________________________________________。
中Se―O的键角比SeO3的键角_______(填“大”或“小”),原因是____________________________________________。
(4)H2Se比H2S水溶液的酸性强,原因是__________________________________。
(5)灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。

①螺旋链中Se原子的杂化方式为______________。
②己知正六棱柱的边长为a cm,高为b cm,阿伏加德罗常数为NA mol-l,则该晶胞中含有的Se原子个数为__________,该晶体的密度为_____________g/cm3(用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(s)+CO(g)![]() Fe(s)+CO2(g)ΔH<0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
Fe(s)+CO2(g)ΔH<0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比___________,平衡常数K___________(以上均填”增大”“减小”或”不变”)。
(2)1100 ℃时测得高炉中c (CO2)=0.025 mol L1,c(CO)=0.1 mol L1,在这种情况下,该反应是否处于化学平衡状态:______________________(填”是”或”否”),此时的化学反应速率是v(正)_________v(逆)(填”大于”“小于”或”等于”),其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,加入等体积0.3mol/L的BaCl2溶液恰好使SO42﹣完全沉淀,则混合溶液中Na+的浓度为( )
A.0.3 mol/L
B.0.45 mol/L
C.0.6 mol/L
D.0.15 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制0.4mol/L的NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.,请回答:
(1)计算需要NaOH固体质量g.
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒.配制以上两种溶液必须使用的玻璃仪器(填序号),还缺少的仪器是 .
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL,如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
(4)配制过程中,下列操作会引起结果偏高的是(填序号) ①未洗涤烧杯、玻璃棒 ②称量NaOH的时间太长
③定容时俯视刻度 ④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶 ⑥量取浓硫酸时,仰视量筒刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 由于在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 使用容量瓶前应先检查其是否漏液
D. 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com