

| A、①②③ | B、④⑤⑥ |
| C、③④⑤ | D、②③⑥ |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| A、含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B、pH相等的NaOH、NaHCO3和Na2CO3三种溶液:c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C、常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D、某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a:b=2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
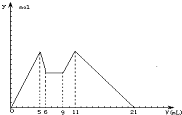 如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )
如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )| A、c(NaOH):c(HCl)=2:1 |
| B、原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5(不考虑离子的水解) |
| C、NaOH和盐酸的分界点是6mL处 |
| D、从7到9,都发生离子反应H++OH-→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苏打-NaHCO3 |
| B、胆矾-CuSO4 |
| C、酒精-CH3OH |
| D、生石灰-CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、C(s、石墨)═C(s、金刚石)△H=+1.9kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、7d | B、5d | C、4d | D、2d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Fe3+、I-、SO42- |
| B、Al3+、Mg2+、HCO3-、Cl- |
| C、K+、Ag+、Ca2+、PO43- |
| D、NH4+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/L |
| B、0.1mol/L |
| C、0.05mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | A | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com