
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����
A.����������ˮ��Ӧʱ������0.1 mol����ת�Ƶĵ���ЧΪ0.2NA
B.��״���£�22.4 L NO��11.2 L O2��ַ�Ӧ������ķ�����ΪNA
C.��100mL 0.1 mol��L��1 FeCl3��Һ�����ˮ�п��Ƶ�Fe(OH)3����0.01 NA
D.Ũ����(��1 mol H2SO4)������Cu���ȷ�����Ӧ����0.5 NA��SO2����
���𰸡�A
��������
A. ����������ˮ��Ӧ�����������ƺ�����������1mol����������ת��2mol����ô����0.1mol��������ת��0.2mol��A����ȷ��
B. ��״���£�22.4 L (��1mol)NO��11.2 L(��0.5mol) O2��ַ�Ӧ��������1molNO2�������ڷ�Ӧ2NO2![]() N2O4����˲���ķ���������NA��B�����
N2O4����˲���ķ���������NA��B�����
C.�������������������������ľۺ��壬��0.1 molFeCl3��Һ�����ˮ�Ƶõ�Fe(OH)3����С��0.01 NA��C�����
D. ��1molH2SO4��Ũ�����������Cu�ڼ��ȵ������·�Ӧ����������ȫ��Ӧ����0.5molSO2�������ŷ�Ӧ�Ľ��У�Ũ����Ũ�Ƚ��ͣ���Ϊϡ�����Ӧֹͣ��������ɵ�SO2��������0.5 NA����D�����
��ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȶ������Ч��������״������������ G �Ǻϳɰ��ȶ�����м��壬��ϳ�·�����£�
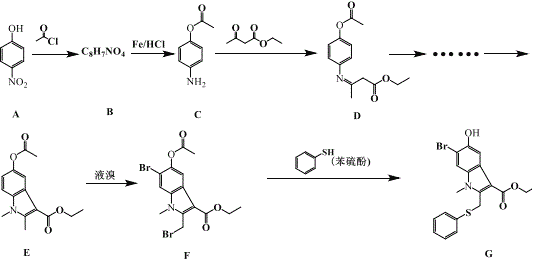
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_____��B �Ľṹ��ʽΪ_____��
��2���� B ��C �ķ�Ӧ���ͷֱ�Ϊ________________��
��3���ںϳɻ�����G�������У���A��B��Ŀ����________________________��
��4������ӵ������뱽�����ƣ�����ӵĹ�����Ϊ_____��д�ṹ��ʽ������ NaOH����Һ�ɵζ��������Һ���ù���ѡ�õ�ָʾ��Ϊ_____��
��5���� D�Ľṹ���жϣ�D Ӧ���������칹���������칹��Ľṹ��ʽΪ_____��
��6��H ��A��ͬϵ�����Է���������A �� 14��H ��ͬ���칹����ͬʱ�������������Ĺ���____�֣������������칹����
�ٱ������� 3 ��ȡ���������� FeCl3 ��Һ��ɫ
�ڼ��ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
д������һ�ֺ˴Ź�������������壬�����֮��Ϊ 1��1��1��2��2 �Ľṹ��ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̿ѭ��(��ͼ)���������桢��չ������Ҫ�����壬����˵���������
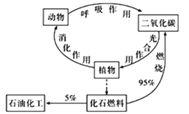
A.̼������л������ҪԪ��
B.��������ǽ�̫����ת��Ϊ��ѧ�ܵĹ���
C.�����������CO2�Ĺ����У������DZ�����
D.̼Ԫ���ڵؿ��к����ḻ��������γɵĻ����������ڶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T ��ʱ��������(Ag2CrO4)��ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ������˵���в���ȷ����

A����Ag2CrO4��Һ�м������K2CrO4��ʹ��Һ��Y���ΪX��
B��T��ʱ����Y���Z�㣬Ag2CrO4��Ksp���
C��T��ʱ��Ag2CrO4 �� Ksp��ֵΪ 1��10-11
D��ͼ��a=![]() ��10-4
��10-4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�ص�ԭ�ӽṹʾ��ͼ��
(1)������Ϊ23��������Ϊ12��ԭ�ӣ�________��
(2)ijԪ��ԭ�ӵ��������������ڴ�����������__________________��
(3)ijԪ�ص�ԭ��L���������M���������2����__________________��
(4)ijԭ�Ӻ���û�����ӵ�Ԫ�أ�________��
(5)��������������������3����ԭ��________��
(6)ijԪ��ԭ�ӵ��������������ڴ�����������2����________��
(7)ijԪ��ԭ��L���ϵĵ�����ΪK���3����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ���л��м��壬��ũҩ��ҽҩ���������ϡ��۰��������Լ������϶���������;������������ˮ�⣬�۵�Ϊ��118��C���е�Ϊ8.2��C��ij����С��ģ�ҵ������һ����̼�������Ļ�����ڻ���̿����������������ȡ�������䷴Ӧԭ��Ϊ��Cl2��CO��COCl2��װ����ͼ��ʾ(�����ļ���װ����ʡ�ԣ�D�����������ռ�����)��
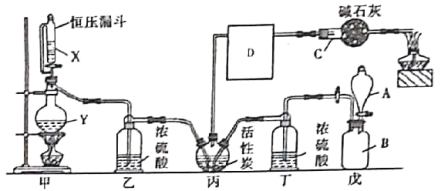
(1)����C������Ϊ___�����м�ʯ�ҵ�����Ϊ________________��D������Ӧ����_____(���ˮԡ������ˮԡ��)�С�
(2)������װ��ɺ����װ�������Եķ�����_________��
(3)��װ����Ҫ������ȡ������������KMnO4��������ȡ����ʱ�����ӷ���ʽΪ__________��
(4)��������ˮ�⣬��ˮ���ײ���һ���⻯���һ��������䷴Ӧ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع����ε�˵����ȷ���ǣ� ��
A.�������е������Ӷ���![]()
B.�����ζ�������ˮ
C.ͨ�������������ʽ��ʾ�����ε���ɣ�˵�������ξ����ɸ�����������ɵ�
D.![]() ��һ�ּĹ����Σ���ˮ��Һ�������ϼ�
��һ�ּĹ����Σ���ˮ��Һ�������ϼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D�������壬A���ܶ���С�����壬B��ͨ������³���ɫ������������ֱ�ͨ��������������Һ�У�ͨ��B��D����ʱ�������ְ�ɫ ������������A������B�а�����ȼ�գ�������ɫ�Ļ��沢����D������ɫ�̼���ζ����Cͨ�����ʯ��ˮʱ����ǡ�
��1��A��B��C��D�ķ���ʽ�ֱ�Ϊ��A__________B_________C___________D_________��
��2��д�����и���Ӧ�Ļ�ѧ����ʽ��
A��B_______________________________________________
B��ˮ_______________________________________________
B��NaOH��Һ_______________________________________
C�����ʯ��ˮ_______________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com