
【题目】随着卤族元素原子序数递增,下列说法正确的是( )
A.单质的氧化性逐渐减弱
B.单质的熔、沸点逐渐降低
C.单质的密度逐渐降低
D.气态氢化物的稳定性逐渐增强
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并______为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
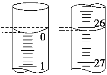
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL,所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次递增的五种常见元素。A、B元素组成的气态化合物M的水溶液呈碱性,C元素是地壳中含量最多的元素,D的单质在C的单质中燃烧后的产物可以使品红溶液褪色,E是金属元素。
(1)写出A、C两种元素组成的化合物A2C2的电子式: ;
(2)A、B、C三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的PH (填大于,小于或等于)7,原因是 ;(用离子方程式表示)
(3)若将E金属投入盐酸中,生成了浅绿色溶液N。则N的酸性溶液与A2C2反应的离子方程式为 ;
(4)R是B的氧化物,通常情况下呈红棕色。现有一试管R,欲使元素B全部转化为它的最高价氧化物对应的水化物,故进行如下实验操作:将盛有R的试管倒扣在水槽中, ;
(5)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式: ,放电时,溶液中的H+移向 (填正或负极)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. PM2.5是指空气中氮氧化物和硫氧化物含量之和
B. 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析
C. 使用无铅汽油的汽车尾气不会污染空气
D. 水体中植物营养物质过多积累会引起水体富营养化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭。发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又作响并鼓起来,下列有关判断正确的是
A.导致易拉罐变瘪的离子反应是CO2+OH![]()
![]()
B.导致易拉罐又鼓起来的反应是Al3++3![]()
![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性
D.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不正确的是
A. 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱
B. 金属Mg失火时不能用泡沫灭火器扑灭
C. 土壤胶粒带负电荷,有利于铵态氮肥的吸收
D. 水玻璃可用于生产黏合剂和防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.2 mol NaOH含有0.2NA个NaOH分子
B.3.2 g O2和O3的混合气体中氧原子数为0.25NA
C.常温下,1 mol Cl2与过量NaOH溶液反应,转移电子总数为NA
D.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,请回答下列问题:
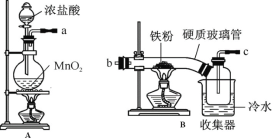
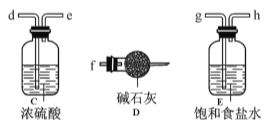
(1)装置的连接顺序为 (用a 、b、c…h表示)。
(2)i.A装置中反应的化学方程式为 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)FeCl3溶液常用于吸收有毒气体H2S。反应的离子方程式为 。
(5)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(过程中不振荡),充分反应后,进行如下实验:

淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为 。
(6)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
根据上述实验得出溶液褪色的原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要食品添加剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)查阅资料:①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
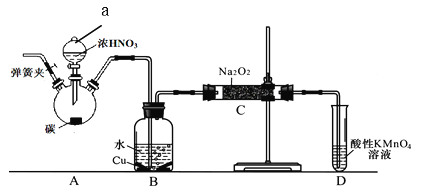
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为 ,A中反应的化学方程式是 ;
(2)D装置的作用是 ;
(3)C中反应生成NaNO2的化学方程式是 ;
(4)检验C中产物有亚硝酸钠的正确操作是 (填序号) ;
a.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2
b.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2
(5)经检验C的产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称);
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com