
【题目】将0.6molA和0.5molB充入0.4L密闭容器中发生2A(g)+B(g)![]() mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol。又知5min内用E表示的平均反应速率为0.1mol·L-1·min-1,计算:
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol。又知5min内用E表示的平均反应速率为0.1mol·L-1·min-1,计算:
(1)m的值___________;
(2)平衡时B的转化率____________;
(3)起始与平衡时密闭容器中的压强之比_____________。
【答案】1 40% 11:9
【解析】
(1)υ(E)=0.1mol·L-1·min-1,5min内生成E的物质的量是0.1 mol·L-1·min-1×0.4L×5min=0.2mol,n(D):n(E)= 0.2mol:0.2mol=m:1,则m=1;
(2)用三段式
2A(g) + B (g)![]() D (g) + E (g)
D (g) + E (g)
起始量(mol) 0.6 0.5 0 0
转化量(mol) 0.4 0.2 0.2 0.2
平衡量(mol ) 0.2 0.3 0.2 0.2
B的转化率为![]() ×100%= 40%;
×100%= 40%;
(3)平衡时混合气总物质的量为0.2mol + 0.3mol + 0.2mol + 0.2mol=0.9mol,起始时混合气总物质的量为0.6mol + 0.5mol =1.lmol,由于容器的容积不变,所以起始与平衡时容器内的压强之比等于气体物质的量之比,故起始与平衡时密闭容器中的压强之比11 : 9。
【点晴】
本题考查化学平衡的有关计算,比较基础。有关化学平衡的计算常常使用三段式解题,要正确理解和灵活运用三段式法在化学平衡计算中的应用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() mC(g)+2D(g),经过5 min后,反应达到平衡。此时测得,D的浓度为0.5 mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1 mol·L-1·min-1.求:
mC(g)+2D(g),经过5 min后,反应达到平衡。此时测得,D的浓度为0.5 mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1 mol·L-1·min-1.求:
①m的值为多少?_____________
②A在5 min末的浓度。__________
③B的平衡转化率。___________
④该反应的平衡常数。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于________(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是________(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是________(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是________(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)某品牌果冻标签如图所示。回答下列问题:

①食品添加剂中,属于无机盐的是______(填化学式)。
②属于着色剂的是诱惑红和______;属于防腐剂的是______。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式______。
(3)化学与科学技术、生产生活及环境保护等密切相关。
①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是______;严格整治畜禽养殖场污染,主要是为减少______和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式____________________________________________________。
③阿司匹林作为一种药物,主要具有______作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CalanolideA是一种抗HTV药物,其结构简式如下图所示。下列关于CalanolideA的说法错误的是

A.分子式为C22H24O5
B.分子中有3种含氧官能团
C.该物质既可发生消去反应又可发生加成反应
D.1mol该物质与足量NaOH溶液反应时消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05molL﹣1min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________。
(2)2min末时X的浓度为_________。
(3)化学反应方程式中n的值是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2排放至空气中会造成大气污染,某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
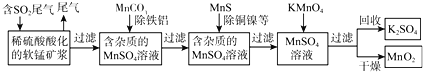
请回答下列问题:
(1)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
根据以上信息写出用MnO2脱硫的热化学方程式是______
(2)第二步加入MnCO3其原因是______
(3)若最后一步所加KMnO4恰好反应完全,如何证明过滤所得的MnO2固体已洗涤干净:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
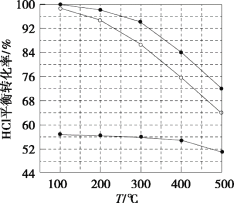
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 56g铁在足量氧气中燃烧,转移的电子数为2NA
B. lg氢气含有NA个氢气分子
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com