
| 5.85g |
| 78g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、含有食品添加剂的食物对人体都有害,不宜食用 |
| B、维生素C也称为抗坏血酸,具有还原性,在水溶液中或受热时很容易被氧化 |
| C、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| D、14C可用于文物的年代鉴定,14C与13C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| 或△ |
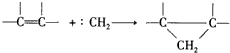
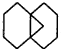 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL容量瓶,7.2g |
| B、100mL容量瓶,8g |
| C、500mL容量瓶,8g |
| D、500mL容量瓶,7.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W | Q |
| A、钠与Y可能形成Na2Y2化合物 |
| B、Z最高价氧化物对应水化物酸性强于W最高价氧化物对应水化物酸性 |
| C、单质的氧化性:W>Q |
| D、原子半径:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com