
【题目】钒及其化合物在工业生产中有着广泛的应用,可作为制硫酸的催化剂,从含钒废料(含有V2O5、V2O4、SiO2、Fe2O3等)中回收V2O5的流程如下:
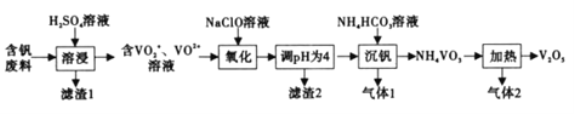
巳知:NH4VO3微溶于冷水,易溶于热水,不溶于乙醇。
回答下列问题:
(1)为提高浸出速率,除适当増加硫酸浓度外,还可采取的措施有______(写出一条),滤渣1的成分是_____________,酸浸时V2O4发生反应的离子方程式为_______________。
(2)“氧化反应”反应中还原剂与氧化剂的物质的量之比为______。
(3)该流程中可循环利用的物质有______(填化学式)。
(4)已知![]() +2H+
+2H+![]()
![]() +H2O,沉钒”过程中,主要反应的离子方程式为______。沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、___________。
+H2O,沉钒”过程中,主要反应的离子方程式为______。沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、___________。
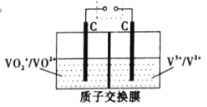
(5)钒电池是目前发展势头强劲的优秀绿色环保电池,全钒液流储能电池就是其中一种,它的正负极活性物质形成的电解质溶液相互分开,该电池采用石墨电极,其工作原理示意如图。放电时正极反应式为_____,充电时质子的移动方向为_____(填“从左向右”或“从右向左”)。
【答案】将含钒废料粉碎、适当提高反应温度、加快搅拌速度等 SiO2或二氧化硅 V2O4+4H+=2VO2++2H2O 2:l CO2、NH3 ![]() +2
+2![]() +
+![]() =NH4VO3↓+2CO2↑+H2O 乙醇洗涤、烘干
=NH4VO3↓+2CO2↑+H2O 乙醇洗涤、烘干 ![]() +e-+2H+=VO2++H2O 从左向右
+e-+2H+=VO2++H2O 从左向右
【解析】
V2O5、V2O4、SiO2、Fe2O3与硫酸反应得到含有![]() 、VO2+、Fe3+的溶液,加入NaClO把VO2+氧化为+5价
、VO2+、Fe3+的溶液,加入NaClO把VO2+氧化为+5价![]() ,调节pH=4使Fe3+转化为Fe(OH)3沉淀,加入碳酸氢铵生成NH4VO3沉淀。
,调节pH=4使Fe3+转化为Fe(OH)3沉淀,加入碳酸氢铵生成NH4VO3沉淀。
(1)根据影响反应速率的因素,为提高浸出速率,除适当増加硫酸浓度外,还可采取的措施有将含钒废料粉碎、适当提高反应温度、加快搅拌速度等,含钒废料中SiO2和硫酸不反应,所以滤渣1的成分是SiO2,酸浸时V2O4和硫酸反应生成VOSO4和水,发生反应的离子方程式为V2O4+4H+=2VO2++2H2O;
(2)“氧化反应”中NaClO把VO2+氧化为+5价![]() ,氯元素化合价由+1降低为-1,V元素由+4升高为+5,还原剂与氧化剂的物质的量之比是2:1;
,氯元素化合价由+1降低为-1,V元素由+4升高为+5,还原剂与氧化剂的物质的量之比是2:1;
(3)沉钒过程发生反应![]() +2
+2![]() +
+![]() =NH4VO3↓+2CO2↑+H2O,NH4VO3加热分解为氨气、V2O5,二氧化碳、氨气溶于水生成碳酸氢铵,该流程中可循环利用的物质有CO2、NH3;
=NH4VO3↓+2CO2↑+H2O,NH4VO3加热分解为氨气、V2O5,二氧化碳、氨气溶于水生成碳酸氢铵,该流程中可循环利用的物质有CO2、NH3;
(4) “沉钒”过程中铵根离子、碳酸氢根离子、![]() 反应生成NH4VO3和二氧化碳气体,主要反应的离子方程式为
反应生成NH4VO3和二氧化碳气体,主要反应的离子方程式为![]() +2
+2![]() +
+![]() =NH4VO3↓+2CO2↑+H2O。根据NH4VO3不溶于乙醇,沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、乙醇洗涤、烘干;
=NH4VO3↓+2CO2↑+H2O。根据NH4VO3不溶于乙醇,沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、乙醇洗涤、烘干;
(5)原电池放电时,氢离子移向正极,![]() 、VO2+的转化需要氢离子,所以放电时左侧是正极、右侧是负极,放电时正极反应式为
、VO2+的转化需要氢离子,所以放电时左侧是正极、右侧是负极,放电时正极反应式为![]() +e-+2H+=VO2++H2O,充电时,左侧为阳极、右侧为阴极,质子的移动方向为从左向右。
+e-+2H+=VO2++H2O,充电时,左侧为阳极、右侧为阴极,质子的移动方向为从左向右。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
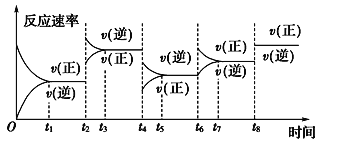
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
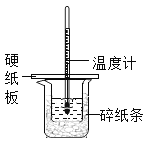
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC(X)=-lgc(X),pKa=-lgKa,常温下,某浓度H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
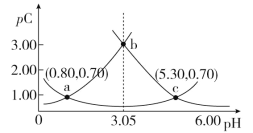
A.随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B.pH=4.50时,c(HA-)>c(A2-)=c(H2A)
C.b点时, =104.50
=104.50
D.pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况)。求:
(1)混合物中铁的质量?___
(2)原稀硫酸的物质的量浓度?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) △H,回答下列问题:
ETBE(g) △H,回答下列问题:
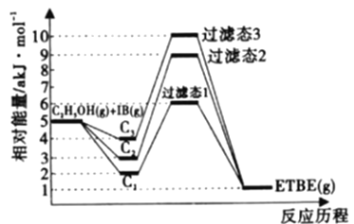
注:C1表示乙醇和异丁烯同时吸附,C2表示先吸附乙醇,C3表示先吸附异丁烯。
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如上图所示,该反应的△H=____akJ·mol-1,下列选项正确的是______(填序号)。
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在温度为378 K与388 K时异丁烯的转化率随时间变化如图所示。
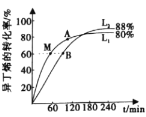
①图中A、M、B三点,化学反应速率由大到小的顺序为______,其中逆反应速率最大的点是______(用符号A、M、B填写)。
②388 K时,容器内起始总压为P0 Pa,用分压表示的该反应的平衡常数K=______Pa-1(用含有P0的式子表示)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:![]() ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
A.其他条件不变,升高温度,k正增大,k逆变小
B.其他条件不变,使用催化剂,k正、k逆同倍数增大
C.其他条件不变,増大反应物浓度k正增大,k逆不变
D.其他条件不变,减小压强,k正、k逆都变小
已知反应速率υ=υ正-υ逆=k正P(C2H5OH)·P(IB)-k逆P(ETBE),计算上图中M点![]() =_______(保留两位小数)
=_______(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应的离子方程式是____,实验中预计通过观察什么现象或测定什么数据来进行判断:_____。
(2)该实验的目的是____。
(3)实验③中的Vx=____;实验①和④测得反应速率分别为v1、v4,则v1____v4(填:“>”“<”和“=”)
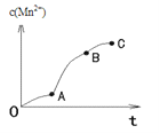
(4)实验①中,c(Mn2+)与t关系如图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,猜想还可能是_____,利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):
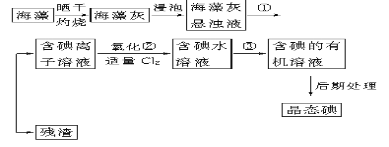
(1)指出提取碘的过程中有关的实验操作名称:①________,③_____________。
(2)提取碘的过程中,可供选择的有机试剂是____________。
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是_______。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出下图所示实验装置中的错误之处:
① ________________________ ②_______________________________ 、③_________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com