
分析 (1)pH试纸的正确使用方法是:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH;
(2)根据盐的类型分析呈碱性,纯碱是强碱弱酸盐水解呈碱性;
(3)用pH试纸测pH值计算水解产生的氢氧根离子的浓度;
(4)根据电荷守恒、物料守恒和质子守恒分析.
解答 解:(1)测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值,
故答案为:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH;
(2)纯碱是强碱弱酸盐,碳酸根离子能发生水解使溶液中的氢氧根离子的浓度大于氢离子的浓度,导致溶液呈碱性,离子方程式为 CO32-+H2O?HCO3-+OH-,故答案为; CO32-+H2O?HCO3-+OH-;
(3)用pH试纸测pH值计算水解产生的氢氧根离子的浓度,其操作为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%,故答案为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%;
(4)①根据物料守恒,碳元素在溶液中的形式有:CO32-、HCO3-、H2CO3、所以c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故答案为:错误;c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);
②根据电荷守恒分析解答,c(Na+)+c(H+)=2 c(CO32-)+c(HCO3-)+c(OH-),故答案为:√;
③根据质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故答案为:错误;c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);
④碳酸钠溶液水解呈碱性,所以离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故答案为:√.
点评 本题考查了盐类水解的原理,溶液酸碱性的实验测定方法,溶液中的守恒关系的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+═CO2↑+H2O | |
| C. | 实验室用烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
| (1)MgO中混有少量Al2O3杂质 | NaOH | Al2O3+2OH-=2AlO2-+H2O |
| (2)FeCl2溶液中混少量FeCl3 | Fe | 2Fe3++Fe=3Fe2+ |
| (3)FeCl3溶液中混少量FeCl2 | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| (4)FeSO4溶液中混少量CuSO4 | Fe | Fe+Cu2+=Cu+Fe2+ |
| (5)NaHCO3溶液中混有少量Na2CO3 | CO2 | CO32-+H2O+CO2=2HCO3- |
| (6)Mg溶液中混有少量Si杂质 | NaOH | 2Si+2OH-+H2O=SiO32-+2H2↑ |
| (7)CO2中混有少量HCl杂质 | NaHCO3 | HCO3-+H+=CO2↑+H2O |
| (8)NaCl溶液中混有少量NaBr | Cl2 | Cl2+2Br-=2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
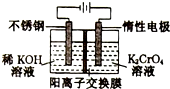
| A. | 电解过程中,K+由阴极室通过阳离子交换膜移阳极室 | |
| B. | 在阴极室,发生的电极反应为:2H++2e-═2H2↑ | |
| C. | 该电解过程实质是电解水 | |
| D. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用NaOH待测液前用少量水洗涤锥形瓶 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 摇动锥形瓶时有少量待测液溅出瓶外 | |
| D. | 滴定前滴定管中有气泡,滴定后消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ中溶液不分层,溶液由棕黄色变成浅绿色 | |
| B. | Ⅱ中溶液分层,下层呈紫红色 | |
| C. | Ⅲ中溶液分层,下层呈紫红色 | |
| D. | Ⅳ中溶液分层,下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 |  | 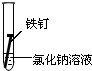 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、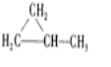 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com