
ij�¶��£���Ӧ2NO2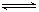 N2O4����H��O�����ܱ������дﵽƽ�⡣ƽ��ʱ�ı����������ʹ��Ӧ�ٴ�ƽ�⣬��ƽ��ʱ��c(NO2)/c(N2O4)��ԭƽ����ȱ���ˣ���ı������Ŀ�����
N2O4����H��O�����ܱ������дﵽƽ�⡣ƽ��ʱ�ı����������ʹ��Ӧ�ٴ�ƽ�⣬��ƽ��ʱ��c(NO2)/c(N2O4)��ԭƽ����ȱ���ˣ���ı������Ŀ�����
A�����������ݻ����¶Ȳ��䣬�������ڲ�����NO2
B����������ѹǿ���¶Ȳ��䣬�������ڲ�����N2O4
C�����������ݻ����¶Ȳ��䣬�������ڲ�����N2
D�������������ݻ����䣬�������¶�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?�Ͼ���ģ����Ч��ת�����ɼ�������β���е���Ҫ��Ⱦ�CO��NOx�ȣ������ַ�Ӧ���£�
��2011?�Ͼ���ģ����Ч��ת�����ɼ�������β���е���Ҫ��Ⱦ�CO��NOx�ȣ������ַ�Ӧ���£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �������ⱸ�������ע���������Լ�����β���ŷŵ�һ����̼��CO�����������NOx������������强��Ϊ������Ⱦ����Ҫ���أ�
�������ⱸ�������ע���������Լ�����β���ŷŵ�һ����̼��CO�����������NOx������������强��Ϊ������Ⱦ����Ҫ���أ� O2+Hb?CO
O2+Hb?CO N2��g��+2CO2��g����H=-113kJ?mol-1
N2��g��+2CO2��g����H=-113kJ?mol-1| 0.4 |
| 15 |
| 0.4 |
| 15 |
 H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯���±���
H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯���±���| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n��CO2�� | 3 | 1 | 0 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 |
| n��CO�� | 1 | 2 | 3 | 0.5 |
| n��H2O�� | 5 | 2 | 3 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�������ʡ����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪ij�¶��£���Ӧ SO2(g)��NO2(g)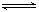 SO3(g)+NO(g)��ƽ�ⳣ��K=0.24������˵����ȷ����
SO3(g)+NO(g)��ƽ�ⳣ��K=0.24������˵����ȷ����
A�����¶��·�Ӧ2SO2(g)��2NO2(g)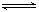 2SO3(g)+2NO(g) ��ƽ�ⳣ��Ϊ0.48
2SO3(g)+2NO(g) ��ƽ�ⳣ��Ϊ0.48
B�����÷�Ӧ��H <0���������¶Ȼ�ѧƽ�ⳣ��K��С
C���������¶ȣ��淴Ӧ���ʼ�С
D���ı�����ʹƽ�������ƶ�����ƽ��ʱn(NO2)/n(NO)һ����ԭƽ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�����ĸ�����һ��ģ�⿼�����⣨���ۣ���ѧ���� ���ͣ������
��14�֣�

I���ҹ����������Լ������˿ռ�վ�����˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��
��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2=2CO+O2��CO������ȼ�ϡ���֪�÷�Ӧ��ij����ӦΪ��4OH-��4e-=O2��+2H2O������һ����ӦΪ�� ��
������������������ij�¶��µķ�Ӧ��2CO=2C+O2����H>O����S<O��������CO����Ⱦ�������жϸ��¶���������Ӧ�Ƿ��ܷ�����˵�������� ��
��.�����̵�������Ȼ�̵����ϳɰ���Ŀǰ�˹��̵�����Ҫ��������ѧ��һֱ�������˹��̵����·������о���
���йش����̵�(��N2+O2 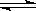 2NOΪ��)���˹��̵�(��N2+3H2
2NOΪ��)���˹��̵�(��N2+3H2 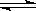 2NH3Ϊ��)��Ӧ��ƽ�ⳣ��
2NH3Ϊ��)��Ӧ��ƽ�ⳣ�� ��ֵ���±���
��ֵ���±���
|
��Ӧ |
N2+02
|
N2+3H2 |
||
|
�¶�/�� |
27 |
2000 |
100 |
400 |
|
K |
3.84��10-31 |
0.1 |
3.4��109 |
2.0x104 |
����˵����ȷ���� ��(����ĸ)
a�������̵����˹��̵����Ƿ��ȷ�Ӧ
b������ģ������̵�����ʵ����
c��Ѱ���ڳ����ºϳɰ��ĸ�Ч������Ŀǰ�˹��̵����·���
d���ڳ����£��˹��̵��dz�������
����֪��N2(g)+3H2(g) 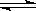 2NH3(g)
2NH3(g)  =-92.4kJ��mol-1
=-92.4kJ��mol-1
2H2(g)+02(g)=2H20(1)
 =-571.6 kJ��mol-1
=-571.6 kJ��mol-1
�ݱ������ڳ��¡���ѹ�����ա������������£�N2������ˮ��Ӧ����Ӧ N2(g)+3H20(1)=2NH3(g)+3��2O2(g)�� = KJ��mol-1��
= KJ��mol-1��
��ij�о�С����673 K��30 MPa�£������Ϊ ���ܱ������н��з�Ӧ��N2(g)+3H2(g)
���ܱ������н��з�Ӧ��N2(g)+3H2(g) 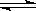 2NH3(g)����
(H2)�� (NH3)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
2NH3(g)����
(H2)�� (NH3)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��

������������ȷ���� ��(����ĸ)
A����a������Ӧ���ʱȵ�b�Ĵ�
B����c����Ӧ�ﵽ��ѧƽ��״̬
C����t3ʱ��673 K����773 K���� (H2)������
�ڴӿ�ʼ��ƽ��ʱ��Ӧ��ƽ������(��H2��Ũ�ȱ仯��ʾ) (H2)= ��
������ʼʱ (N2)= (H2)����Ӧ��ƽ�ⳣ�� =
(�ô���ʽ��ʾ)��
=
(�ô���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com