
分析 NaHCO3受热分解,发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,根据n=$\frac{m}{M}$计算NaHCO3的物质的量,根据方程式计算生成二氧化碳的物质的量,根据V=nVm计算二氧化碳的体积;二氧化碳通入足量的石灰水,发生反应Ca(OH)2+CO2═CaCO3↓+H2O,根据方程式计算生成碳酸钙的物质的量.
解答 解:33.6gNaHCO3的物质的量=$\frac{33.6g}{84g/mol}$=0.4mol,
设碳酸氢钠分解生成的二氧化碳为xmol,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
2 1
0.4mol xmol
故$\frac{2}{1}$=$\frac{0.4}{x}$,解得x=0.2
故二氧化碳的体积为0.2mol×22.4L/mol=4.48L,
设生成碳酸钙的物质的量为ymol,则:
Ca(OH)2+CO2═CaCO3↓+H2O
1 1
0.2mol ymol
故$\frac{1}{0.2}$=$\frac{1}{y}$,解得y=0.2,
答:在标况下生成气体的体积是4.48L.得到的沉淀的物质的量是0.2mol.
点评 本题考查根据方程式进行的计算,比较基础,掌握发生的反应是关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
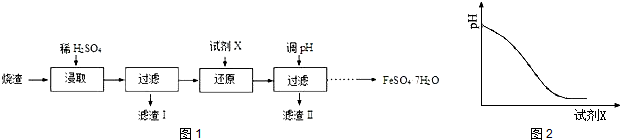
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
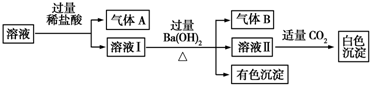
| A. | A是CO2,B是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+ | |
| D. | 溶液中一定不存在Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气混合并光照 | B. | 乙醇和酸性高锰酸钾溶液的反应 | ||
| C. | 乙烯生成聚乙烯 | D. | 苯和氢气反应生成环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 既是氧化剂,又是还原剂 | |
| B. | Fe2O3在反应中得到电子 | |
| C. | 3 mol Na2O2参加反应,转移的电子总数为12mol | |
| D. | Na2FeO4能消毒杀菌,因其具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)
侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 各组分浓度不再发生变化 | ||
| C. | 反应体系中某组分的组成保持不变 | D. | 正、逆反应速率都为零 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com