


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、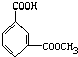 |
B、 |
C、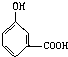 |
D、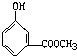 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY3一定是离子化合物 |
| B、若Y的原子序数为m,X的原子序数可能是m±4 |
| C、X和Y一定属于同一周期 |
| D、X和Y一定不属于同一主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加NaOH溶液后进行分液来分离乙醇和苯酚 |
| B、测定Na2CO3、Na2SO4两溶液的pH,比较碳、硫的非金属性强弱 |
| C、在MgCl2、AlCl3溶液中分别通入NH3,比较镁、铝的金属性强弱 |
| D、称量2.5gCuSO4?5H2O晶体溶于100mL水配制0.10mol?L-1的硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
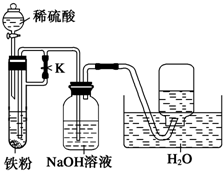 常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验:
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-丁烯中,所有碳原子一定在同一个平面上 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| D、苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
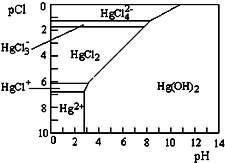 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)].
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com