
| A、XY3一定是离子化合物 |
| B、若Y的原子序数为m,X的原子序数可能是m±4 |
| C、X和Y一定属于同一周期 |
| D、X和Y一定不属于同一主族 |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
| A、标准状总下11.2L臭氧中含有1.5NA个氧原子 |
| B、NO2与N2O4混合气体46g含有的原了总数为3NA |
| C、1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
| D、100mL 0.2mol?L-1稀硫酸中含有硫酸根的个数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:
向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
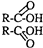
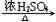
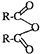 +H2O
+H2O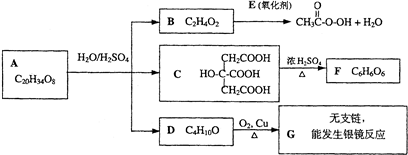
查看答案和解析>>
科目:高中化学 来源: 题型:
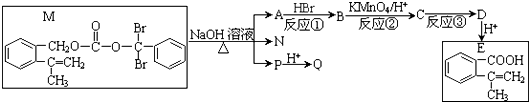
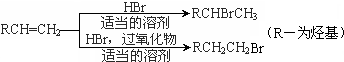 .请回答下列问题:
.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)| T/K | 323 | 373 |
| K值 | 0.022 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置甲的作用是混合气体、干燥等 |
| B、所需的催化剂为铁触媒 |
| C、乙处导出的气体是SO3、SO2、O2 |
| D、虽SO3极易溶于水,但生成的三氧化硫不宜直接通入水中吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com