
 向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:
向纯醋酸加水,溶液的导电能力随着加入水的量的变化如图所示:| c(CH3COO -)c(H +) |
| c(CH3COOH) |
| 10 -14 |
| 10 -x |
| c(CH3COO -)c(H +) |
| c(CH3COOH) |
| 10 (x-14)×10 (x-14) |
| 0.1 |


科目:高中化学 来源: 题型:
| A、选用有效的催化剂能增大正反应速率并提高SO2的转化率 | ||
| B、增大反应体系的压强,反应速率不一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol |
| B、1.6mol |
| C、2mol |
| D、4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、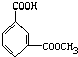 |
B、 |
C、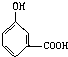 |
D、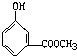 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH,醇 |
| Br2水 |
| NaOH,H2O |
| O2,催化剂 |
| △ |
| O2,催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY3一定是离子化合物 |
| B、若Y的原子序数为m,X的原子序数可能是m±4 |
| C、X和Y一定属于同一周期 |
| D、X和Y一定不属于同一主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
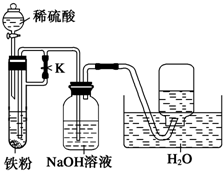 常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验:
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气发生反应,为了验证反应产物,长郡中学化学兴趣小组的同学进行了下述实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
| B、工艺师利用盐酸蚀刻石英制作艺术品 |
| C、除去CO2中少量的SO2,使混合气体通过盛饱和碳酸钠溶液的洗气瓶 |
| D、我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com