
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1L1mol·L-1 的CH3COONa溶液中微粒数目等于2NA
B.1molCnH2n+2中含有的共价键数为(3n+1)NA
C.常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
D.标准状况下,8.0gSO3含有的分子数为0.1NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.标况下,1.12LCl2溶于水,转移0.05NA电子
B.向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3·H2O
C.常温下,由水电离出的H+浓度为10-13mol·L-1的溶液中,Fe2+、Cl-、:Na+、NO3-可能大量共存
D.葡萄糖(C6H12O6)溶液中:SO42-、MnO42-、K+、H+可以大量共存
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三下学期第一次模考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
I.S4N4的结构如图:

(1)S4N4的晶体类型是__ _。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3= S4N4 +S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是__ _。
a.离子键
b.极性键
c.非极性键
d.金属键
e.配位键
f.范德华力
②S2Cl2中,S原子轨道的杂化类型是 __ __。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:

(3)基态Cu2+的最外层电子排布式为_ _。
(4)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是 _ 。
(5)lmol二甘氨酸合铜(II)含有的二键数目是 _ 。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是 ______(填写编号)。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省湖州市高三上学期期末考试化学试卷(解析版) 题型:推断题
(8分)常见有机物A、B、C、D、E、G间的转化关系如下图所示(以下变化中,某些反应条件及产物未标明)。B是天然有机高分子化合物,C、D可发生银镜反应,在相同条件下,G蒸气密度是氦气的22倍。

(1)B的分子式为 、G、的结构简式为 。
(2)E中官能团的名称 。
(3)A的同分异构体的结构简式 。
(4)A→D反应的化学方程式: 、其反应类型是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省湖州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.酸性高锰酸钾与少量双氧水反应:2MnO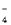 +7H2O2+6H+= 2Mn2++6O2↑+10H2O
+7H2O2+6H+= 2Mn2++6O2↑+10H2O
B.用石墨电极电解饱和MgCl2溶液:2Cl-+ 2H2O 2OH-+ Cl2↑+ H2↑
2OH-+ Cl2↑+ H2↑
C.Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++ HCO3-+OH—=MgCO3↓+H2O
D.向NaClO溶液中通入过量CO2;CO2+ClO—+H2O=HCO3-+HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高二下学期3月月考化学试卷(解析版) 题型:填空题
(8分) Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d64s2。
(1)Z位于元素周期表第________周期第________族,
(2)W的第一电离能________(填“大于”或“小于”)X的第一电离能。
(3)Z基态原子的价电子排布图为______________________________________,Z的单质与过量的X 的最高价氧化物对应的水化物的稀溶液反应的离子方程式为____________________。
(4)已知:①WQ4(g)+4XY2(g)=4XY(g)+WY2(g)+2Q2Y(g) ΔH=-574 kJ/mol
②WQ4(g)+4XY(g)=2X2(g)+WY2(g)+2Q2Y(g) ΔH=-1 160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)WQ4还原XY2至X2。整个过程中放出的热量为___kJ。
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高二下学期3月月考化学试卷(解析版) 题型:选择题
下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
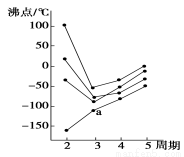
A.H2S B.HCl C.PH3 D.SiH4
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高二下学期3月月考化学试卷(解析版) 题型:选择题
已知某元素原子的各级电离能数值如下:I1=736 kJ/mol,I2=1450 kJ/mol,I3=7740 kJ/mol,I4=10500 kJ/mol,则该原子的最外层电子数为
A.+1 B.+2 C.+3 D.+4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三一模理综化学试卷(解析版) 题型:实验题
(15分)某小组用下图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验)。

实验操作和现象:
操作 | 现象 |
打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀。 |
用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a.S2O32—有较强的还原性
b.酸性条件下S2O32—迅速分解为S和SO2
(1)A中发生反应的离子方程式是 。
(2)B中饱和NaCl溶液的作用是 。
(3)C中生成黄色沉淀的离子方程式是 。
(4)为检验C中是否有SO2生成,需进行的操作是 。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是 。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com